|
Pianeta
Chimica.it
Responsabile:
Prof. Mauro Tonellato
|
|
MODELLISTICA MOLECOLARE
CON ArgusLab
6^ LEZIONE
LEGAME COVALENTE
|
| |
|
|
|
Lezioni con
ArgusLab
 1-butene
e 2-butene 1-butene
e 2-butene
 Carbocatione
1° e 2° Carbocatione
1° e 2°
 Acetone
e tautomeria Acetone
e tautomeria
 Dieni
coniugati (pdf) Dieni
coniugati (pdf)
 Benzene
e aromaticità (pdf) Benzene
e aromaticità (pdf)
 Legame covalente
Legame covalente
 Conformazione alcani
Conformazione alcani
 Ponte Cloronio
Ponte Cloronio
 Diels-Alder
Diels-Alder
 Enolo
Mono e Disostituito (pdf)
Enolo
Mono e Disostituito (pdf)
Lezioni con
MGL Tools / AutoDock
 Struttura delle Proteine
Struttura delle Proteine
 Proteine e Legandi
Proteine e Legandi
 Docking su COX2
Docking su COX2
 Progettare
nuovi farmaci
Progettare
nuovi farmaci
 Chimica
al Computer Chimica
al Computer
 PianetaChimica home
PianetaChimica home
|
|
Per seguire questa lezione dovete avere già visto la 1^ e la
2^ lezione di modellistica molecolare con ArgusLab nelle quali sono
state spiegate le procedure di base che qui verranno date per conosciute.
Arguslab 4.01 può essere scaricato gratuitamente qui:
http://www.arguslab.com
Questa lezione può essere affrontata in due modi:
1) Online. Potete leggere le istruzioni ed eseguirle passo passo
al computer con ArgusLab, aiutandovi con le illustrazioni che chiariscono
ogni passaggio.
2) In aula informatica con la classe. Se siete insegnanti di
chimica, potete adattare la lezione alle esigenze della vostra classe
e proporla in aula informatica ai vostri allievi.
La durata della lezione è di circa due ore.
N.B. Cliccando sulle immagini potrete vederle a pieno schermo.

Gli argomenti di questa lezione sono:
-- Legame covalente secondo le due teorie del legame di valenza VB e
dell'orbitale molecolare MO
-- Orbitali di legame e antilegame di semplici molecole come H2
, N2 , CH4
|
|
|
|

Legame covalente
Il legame covalente è dato dall'attrazione elettrostatica che
si realizza quando due atomi si avvicinano, sovrappongono due orbitali
semipieni (oppure un orbitale pieno ed uno vuoto) e formano un nuovo
orbitale molecolare nel quale condividono una coppia di elettroni.
Questa è la spiegazione più semplice del legame covalente
che si trova sui libri di testo. Si rifà alla teoria di Lewis
detta del legame di valenza VB (Valence Bonding) che identifica
ogni legame con un preciso orbitale molecolare dato dalla
sovrapposizione di due orbitali atomici.
Per spiegare la geometria delle molecole poliatomiche, la troria VB
usa orbitali atomici ibridi, cioè rimescola gli orbitali
atomici s e p e ottiene gli ibridi sp che hanno geometria lineare, gli
ibridi sp2 che sono planari trigonali, gli ibridi sp3 tetraedrici.
Esiste però anche un'altra teoria detta dell'orbitale molecolare
MO (Molecular Orbital) che calcola la forma e l'energia degli orbitali
molecolari nello stesso modo col quale si calcolano gli orbitali atomici.
Quindi gli elettroni di valenza occupano orbitali molecolari dati dal
campo elettrostatico generato da tutti i nuclei della molecola e da
tutti gli elettroni presenti. Il calcolo matematico naturalmente è
molto complicato, ma oggi con la straordinaria potenza di calcolo dei
computer si può risolvere il problema anche per molecole complesse.
Per la verità un approccio semplificato alla teoria MO calcola
gli orbitali molecolari facendo una combinazione lineare degli orbitali
atomici (LCAO), in questo modo si eseguono somme o sottrazioni
di orbitali atomici per ottenere i corrispondenti orbitali molecolari.
Una conseguenza di questo approccio è che da n orbitali atomici
di partenza si ottengono n orbitali molecolari finali, metà
di questi di legame (cioè con energia più bassa
di quelli atomici) e metà di antilegame (cioè con
energia maggiore)
Un'altra conseguenza è che un legame tra due atomi è
dato dalla sovrapposizione di molti orbitali molecolari, non
c'è più quindi la corrispondenza, tipica della reoria
VB, tra legame e orbitale molecolare.
|
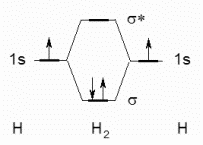
fig. 1
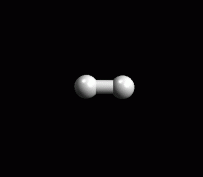
fig. 2

fig. 3 (1 HOMO)

fig. 4 (2 LUMO)

fig. 5
|
|

Molecola H2
L'esempio più elementare di legame covalente è offerto dalla
molecola di idrogeno H2.
La sovrapposizione dei due orbitali semipieni 1s di due atomi di
idrogeno, produce due orbitali molecolari, uno di energia minore chiamato
s (sigma)
di legame e l'altro di energia maggiore chiamato s*
(sigma asteriscato) di antilegame (figura 1).
I due elettroni della molecola occupano solo l'orbitale di legame s
che è di più bassa energia e quindi l'energia della molecola
H2 è minore
di quella dei due atomi separati.
Usando ArgusLab, create la molecola H2
(figura 2). L'atomo di idrogeno è disponibile cliccando
Periodic Table nella finestra di costruzione delle molecole.
Ottimizzate la geometria molecolare col metodo UFF e poi con AM1.
Create gli orbitali molecolari con la procedura già studiata: (Calculation,
Energy, Surface Properties).
Osservate che la molecola possiede solo due orbitali molecolari, 1
Homo e 2 Lumo che corrispondono a s
e s*. Cliccate
su entrambi, date OK, poi cliccate start nella finestra
successiva. Il programma calcola le superfici degli orbitali.
Ora con Surfaces, Make Surfaces, RHF MOs, compare
la lista delle superfici già calcolate.
Trascinate RHF MO1 nel riquadro Grid e sotto in Surface
Name scrivete 1 Homo, poi premete Create>> e nel riquadro
di destra compare l'orbitale 1 Homo, cliccatelo e poi cliccate
Toggle Display per accendere la piccola sfera colorata a fianco
del nome. Date OK e vedrete l'orbitale molecolare come una grossa
sfera blu. Cliccateci sopra col pulsante destro e scegliete Modify
Surface, Mesh. L'orbitale diventerà trasparente come
in figura 3.
Questo è l'orbitale di legame della molecola di idrogeno
ed è stato ottenuto matematicamente dalla somma degli orbitali
atomici (1s + 1s) infatti è tutto blu (segno matematico
positivo o fase positiva).
Ripetete la procedura appena fatta con RHF MO2 e chiamate l'orbitale
2 Lumo. Con Toggle Display spegnete 1 Homo e accendete 2 Lumo.
Trasformatelo in Mesh e avrete la situazione di figura 4.
Questo è l'orbitale di antilegame della molecola di idrogeno
ed è stato ottenuto matematicamente della differenza degli orbitali
atomici (1s - 1s) infatti, nei pressi dell'orbitale preso col segno meno,
il lobo risultante è rosso (segno matematico negativo o fase negativa).
Nella zona a metà tra i due atomi i due orbitali hanno circa
gli stessi valori e quindi la differenza (1s - 1s) è zero e quindi
anche la densità elettronica è zero. Nell'orbitale
di antilegame gli elettroni non possono occupare la zona compresa tra
gli atomi e quindi tendono a rompere il legame.
Accendete infine anche l'orbitale 1 Homo con Toggle Display e date OK.
Avrete una visione complessiva degli orbitali come in figura 5.
|
|
|
|

E' migliore la teoria VB o quella MO?
La trattazione VB del legame di valenza individua solo un orbitale molecolare,
quello di legame (figura 3), mentre la teoria MO individua due orbitali
molecolari, quello di legame e quello di antilegame (figura 5). A questo
punto è lecito chiedersi: è meglio la trattazione MO
o quella VB?
Gli elettroni occupano normalmente solo gli orbitali di legame per cui,
nella maggior parte dei casi, la teoria VB è sufficiente e non
serve invocare la teoria più complicata MO.
Alcune molecole però hanno un comportamento chimico che
può essere compreso solo utilizzando la teoria più sofisticata
MO dei legami e degli antilegami. Per esempio, l'ossigeno O2
si comporta chimicamente come un radicale,
ma solo la teoria MO è in grado di spiegare la presenza di elettroni
spaiati nella molecola che risulta quidi paramagnetica, mentre la teoria
VB descrive O2 con
tutti gli elettroni appaiati e prevede che la molecola sia diamagnetica.
In questi casi particolari è opportuno ricorrere alla trattazione
MO.
Consideriamo poi che gli antilegami sono quegli orbitali vuoti a più
alta energia dove vanno gli elettroni che vengono eccitati nella spettroscopia
visibile e ultravioletta. Quindi, per comprendere gli spettri UV-Visibile
è necessario invocare la teoria MO.
Inoltre quando due molecole reagiscono tra loro, deve sempre succedere
che un orbitale pieno di una molecola interagisca con un orbitale vuoto
dell'altra. Quindi per comprendere la reattività delle molecole
bisogna studiare su una molecola l'orbitale pieno più reattivo,
chiamato HOMO (Highest Occupied Molecular Orbital) e sull'altra
molecola l'orbitale di antilegame più accessibile, chiamato
LUMO (Lowest Unoccupied Molecular Orbital) |

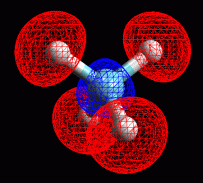
Metano: sigma 1

Metano: sigma 2

Metano: sigma 3

Metano: sigma 4
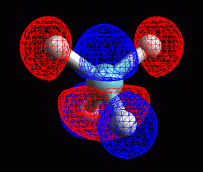
Metano: sigma 5 antilegame
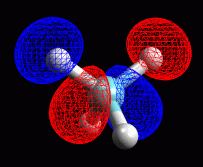
Metano: sigma 6 antilegame
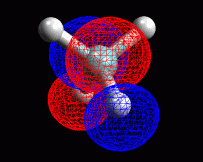
Metano: sigma 7 antilegame
|
|

Molecola CH4
Consideriamo ora una molecola un po' più complessa, il metano
CH4.
La geometria delle molecole poliatomiche viene spiegata dalla teoria
VB con la formazione di orbitali ibridi. Secondo la teoria VB, nel
metano, il carbonio rimescola i suoi orbitali atomici 2s, 2px, 2py e
2pz per formare quattro orbitali ibridi sp3
perfettamente identici tra loro, diretti secondo i vertici di un tetraedro
regolare. Sovrapponendo ognuno di questi orbitali ibridi sp3
con un orbitale 1s di un atomo di idrogeno si formano quattro orbitali
molecolari identici che costituiscono i quattro legami identici
C-H del metano che formano tra loro angoli di 109°.
Questa spiegazione è perfettamente in accordo con i dati sperimentali
di diffrazione di raggi X che dicono che la molecola del metano
è tetraedrica e ha 4 legami identici.
Anche la spettroscopia NMR mostra un unico picco dovuto a quattro
atomi di idrogeno indistinguibili.
La teoria MO, invece, prevede per il metano orbitali molecolari
diversi.
Secondo la teoria MO, gli otto orbitali atomici dei quatro idrogeni
e del carbonio danno origine a otto orbitali molecolari, quattro
di legame e quattro di antilegame come è mostrato nel seguente
schema:
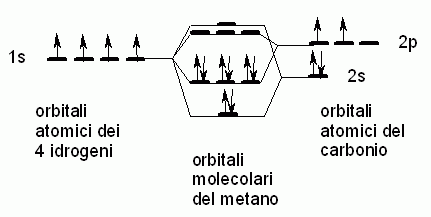
I quattro orbitali di legame non sono degeneri,
ma uno di questi (sigma 1) ha energia minore degli altri tre.
Le conclusioni della teoria MO sembrano in contrasto con i più
comuni dati sperimentali.
La spettroscopia fotoelettronica, però, strappando uno
per uno gli elettroni del metano, è la sola in grado di misurare
l'energia dei singoli orbitali molecolari e non semplicemente l'energia
dei legami C-H. La spettroscopia fotoelettronica registra un orbitale
a più bassa energia e tre orbitali degeneri ad energia maggiore
in perfetto accordo con le previsioni MO mostrate nello schema qui sopra.
Provate a creare voi stessi gli otto orbitali molecolari di legame
e di antilegame del metano usando ArgusLab. Otterrete gli otto orbitali
molrcolari mostrati qui a lato. I primi quattro sono gli orbitali di
legame sigma 1, 2, 3, 4.
L'orbitale sigma 1 è quello di energia minore, è dato
dalla sovrapposizione dell'orbitale 2s del carbonio con gli orbitali
1s dei quattro idrogeni. Gli orbitali 2, 3 e 4 sono ottenuti sovrapponendo
gli orbitali 2px,
2py e 2pz
con alcuni delgli orbitali 1s degli idrogeni, alcuni presi col segno
più, altri col segno meno.
Il totale dei quattro orbitali produce una molecola
simmetrica e tetraedrica.
Chiameremo C-Ha,
il legame C-H in alto a sinistra nella molecola di metano mostrata qui
a fianco..
L'orbitale sigma 1 (generato dall'orbitale 2s del carbonio)
è coinvolto in 4 legami CH, quindi il suo contributo al legame
C-Ha è 1/4.
L'orbitale sigma 2 (generato dall'orbitale 2px del carbonio)
è coinvolto in 2 legami CH, ma non coinvolge il legame C-Ha.
L'orbitale sigma 3 (generato dall'orbitale 2py del carbonio)
è coinvolto in 2 legami CH, il suo contributo al legame C-Ha
è 1/2.
L'orbitale sigma 4 (generato dall'orbitale 2pz del carbonio)
è coinvolto in 4 legami CH, il suo contributo al legame C-Ha
è 1/4.
Complessivamente il legame C-Ha
è prodotto da tre orbitali molecolari
sigma 1 (1/4), sigma 3 (1/2), sigma 4 (1/4),
che hanno rispettivamente un contributo dagli orbitali del carbonio
2s (1/4), 2py (1/2), 2pz (1/4).
Quindi un contributo di 1/4 di orbitale 2s e 3/4 di orbitali
2p del carbonio.
Questa descrizione è la stessa della teoria VB che dice che il
carbonio forma questi legami usando orbitali ibridi sp3
che appunto sono formati da 1/4 di orbitale 2s e 3/4 di orbitali
2p.
La differenza è che la teoria VB rimescola gli orbitali
atomici PRIMA di formare i legami e così ogni legame è
costituito da un singolo orbitale molecolare formato dalla sovrapposizione
di un orbitale ibrido sp3
del carbonio con un orbitale 1s dell'idrogeno.
La teoria MO produce orbitali molecolari usando gli orbitali
atomici puri, non ibridati. Gli orbitali molecolari ottenuti sono multicentrici
e in ogni legame vi è un contributo di più orbitali molecolari
che quindi di fatto si mescolano tra loro, ma solo DOPO che si
è formata la molecola.
Se, fino a qui, le due teorie VB ed MO sono
risultate quasi identiche al punto che solo la spettroscopia fotoelettronica
ne ha rivelato la differenza, le cose cambiano di molto quando consideriamo
gli orbitali di antilegame che sono del tutto assenti nella teoria
VB.
Qui a fianco sono mostrati gli orbitali sigma di antilegame 5, 6,
7, 8 del metano.
Si nota una stretta somiglianza tra coppie di orbitali di legame e antilegame.
Sigma 4 e 5 hanno la sola differenza che l'rbitale 2pz è preso
con segno opposto.
Sigma 3 e 6 hanno gli orbitali 1s degli idrogeni di segno opposto.
Sigma 2 e 7 hanno gli orbitali 1s degli idrogeni di segno opposto.
Sigma 1 e 8 hanno l'orbitale 2s del carbonio di segno opposto.
|
|
Metano: sigma 8 antilegame
|
|

Conclusioni
Ma allora gli orbitali ibridi della teoria VB esistono o non esistono?
La risposta è NO, gli orbitali ibridi non esistono, ma offrono
un modo semplice ed efficace per comprendere la struttura delle molecole.
Secondo la teoria VB, gli orbitali atomici vengono rimescolati PRIMA
di fare i legami e gli orbitali ibridi che si ottengono realizzano
POI legami localizzati tra coppie di atomi.
Secondo la teoria MO, invece,gli orbitali atomici partecipano senza ibridarsi
alla formazione degli orbitali molecolari, il rimescolamento avviene dopo
nel senso che il legame tra due atomi è costituito da più
orbitali molecolari multicentrici.
La teoria VB con i suoi orbitali ibridi localizzati tra coppie
di atomi risulta più semplice ed immediata, e spesso si rivela
molto efficace nel prevedere la struttura e il comportamento delle molecole.
Infatti, anche se la realtà delle molecole è più
complessa, la geometria molecolare può essere predetta utilizzando
teorie semplificate come quella degli orbitali ibridi o
la teoria VSEPR.
La trattazione MO, d'altra parte, è più rigorosa
e più vicina alla realtà, ma è difficile da utilizzare
in modo intuitivo.
La teoria VB offre quindi un approccio semplificato alla descrizione
delle geometrie molecolari con la sua teoria degli orbitali ibridi
e della risonanza e inoltre permette di descrivere i meccanismi
di reazione in modo elementare ed intuitivo.
Ecco perchè nello studio quotidiano della Chimica Organica utilizzeremo
sempre l'approccio VB.
Quando, però, sarà necessario comprendere meglio la reattività
delle molecole ricorrendo allo studio degli orbitali HOMO e LUMO,
allora utilizzeremo la teoria MO. Però non lo potremo fare
in modo intuitivo, con carta e penna, ma dovremo affidarci alla potenza
di calcolo di un computer per risolvere, con programmi di modellistica
molecolare come ArgusLab, la struttura della molecola e calcolare matematicamente
la struttura e l'energia degli orbitali molecolari di legame e di antilegame.
Autore: prof
Mauro Tonellato
|
|
|
|

 Chimica
al Computer Chimica
al Computer
 PianetaChimica home
PianetaChimica home
|
|
|
|
|
|
|
|
|
|
|
|