CHIMICA DEI CARBOIDRATI
Appunti di lezione del Prof. Mauro Tonellato - Itis Natta - Padova
CHIMICA DEI CARBOIDRATI
Appunti di lezione del Prof. Mauro Tonellato - Itis Natta - Padova
Carboidrati e semiacetali
Gli alcoli possono
sommarsi reversibilmente alle aldeidi formando i semiacetali.
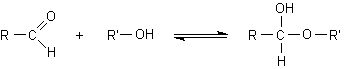
aldeide ...........alcol .........................semiacetale
In generale, però, la formazione del semiacetale tra un alcol e un'aldeide è una reazione sfavorita ed è quindi spostata verso sinistra. Infatti, anche se i legami formati sono globalmente più stabili di quelli di partenza, la reazione è svantaggiosa in termini di disordine molecolare, cioè di entropia, dato che due molecole, l'alcol e l'aldeide, condensano per darne una, il semiacetale.
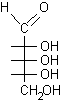
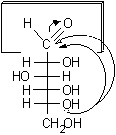
I monosaccaridi costituiscono un'eccezione a questa regola generale infatti possiedono contempo-raneamente il gruppo aldeidico e quello alcolico nella stessa molecola e quindi possono formare un semiacetale ciclico per condensazione intramolecolare.
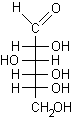
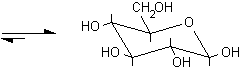
Nel glucosio la formazione del legame semiacetalico porta alla chiusura di un anello a sei atomi privo di tensioni. Questa reazione risulta altamente favorita dato che non comporta diminuzione del numero di molecole e quindi l'entropia non è più sfavorevole. Il D-glucosio esiste, all'equilibrio, prevalentemente in forma ciclizzata nella quale l'ossidrile in posizione 5 ha reagito con il C-1 aldeidico formando un legame semiacetalico intramolecolare, mentre solo una piccola quantità, lo 0.02%, resta nella forma aldeidica libera.
 ......
...... .................
.................![]() .................
.................
![]()
D (+) glucosio ......................D (+) glucopiranosio ..........................Pirano ..................Furano
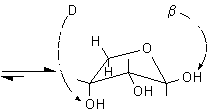
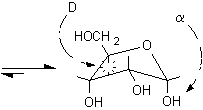
In linea di principio, tutti e cinque gli ossidrili potrebbero sommarsi al gruppo carbonilico per formare semiacetali ciclici di diversa grandezza. Di solito, però, risulta preferita la formazione dell'anello a sei atomi che viene chiamato piranosio, nome derivato dal pirano, un etere ciclico mostrato in figura. In alternativa si può formare un anello a cinque atomi chiamato furanosio, dal furano. A differenza del glucosio, che esiste soprattutto come piranosio, il fruttosio può dare sia un anello a sei che a cinque atomi chiamati rispettivamente fruttopiranosio e fruttofuranosio che all'equilibrio in soluzione sono presenti nella proporzione 70 : 30.
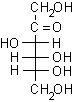 .......
.......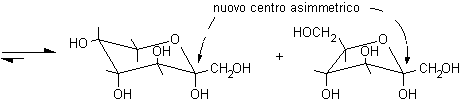
D (-) fruttosio................. D (-) fruttopiranosio (70%).............. D (-) fruttofuranosio (30%)
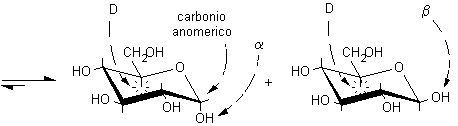
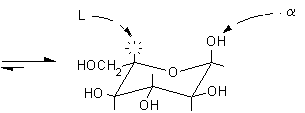
Si osservi che la formazione dei furanosi e dei piranosi crea un nuovo centro asimmetrico nella molecola dei monosaccaridi dato che il carbonio carbonilico sp2 viene trasformato in un carbonio semiacetalico asimmetrico sp3. Come si vede nelle figure a pagina 2, l'ossidrile può attaccare il carbonio aldeidico da sopra o da sotto il piano molecolare sp2, formando due diversi semiacetali isomeri chiamati anomeri e b, il nuovo carbonio asimmetrico viene chiamato anche carbonio anomerico.
Proiezioni di Fischer
Le strutture cicliche di glucosio e fruttosio sono state disegnate nella pagina
precedente usando le proiezioni conformazionali. Questo è il modo più
moderno e corretto per rappresentarle, ma esistono altre due convenzioni accettate:
le proiezioni di Fischer e di Haworth.
Le proiezioni di Fischer delle strutture cicliche semiacetaliche offrono il vantaggio di essere facilmente correlabili alle strutture di Fischer aperte. Per convenzione la molecola va disegnata verticale nella forma completamente eclissata con il carbonio più ossidato verso l'alto. I carboni asimmetrici occupano il centro dei legami a croce, i legami verticali si intendono diretti sotto il piano del foglio, i legami orizzontali verso chi guarda. Per chiudere il ciclo si usa il solo legame semiacetalico che quindi assume una lunghezza e una forma anomale.
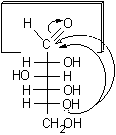 .....
.....
D-glucosio......................... a-D-glucopiranosio....................b-D-glucopiranosio......
Si ottengono così i due anomeri
a e
b che differiscono
solo per la configurazione sul carbonio anomerico e vengono chiamati a
o b in base alla
seguente definizione:
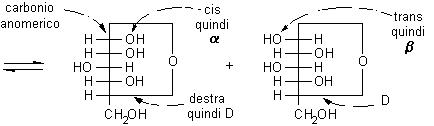
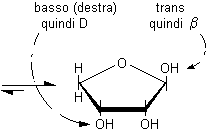
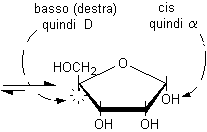
nell'anomero a,
disegnato secondo le proiezioni di Fischer, l'OH anomerico è diretto
verso destra negli zuccheri della serie D, mentre è diretto
verso sinistra negli zuccheri della serie L. L'OH anomerico a,
quindi, si trova dalla stessa parte dell'OH principale (quello che determina
la configurazione D o L della molecola), mentre l'OH anomerico b
è rivolto dalla parte opposta rispetto all'OH principale.
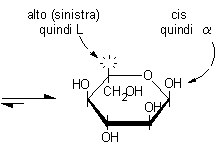
Proiezioni di Haworth
Le proiezioni di Haworth rispecchiano meglio la reale struttura
tridimensionale degli zuccheri. Secondo questa convenzione l'etere ciclico deve
essere rappresentato come un esagono o un pentagono con il carbonio anomerico
a destra e l'ossigeno eterociclico in alto. I legami che escono dall'anello
devono essere disegnati come trattini verticali.
 ......
......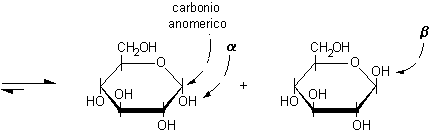
D-glucosio .............................a-D-glucopiranosio............ b-D-glucopiranosio........
Per capire le relazioni tra struttura di Fischer aperta e struttura di Haworth è utile l'uso di modelli molecolari. Nelle figure di pagina 3 è mostrata passo passo la trasformazione di una proiezione di Fischer in una di Haworth. Si consiglia di seguire in modo particolare la posizione dell'OH principale, quello legato al carbonio asimmetrico principale che determina la configurazione D o L della molecola.
Il primo passo della trasformazione è la rotazione della struttura di Fischer verso destra di 90 gradi, in questo modo le parti che si trovano a destra in Fischer vengono a trovarsi in basso nella struttura ruotata.
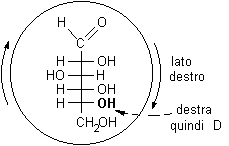
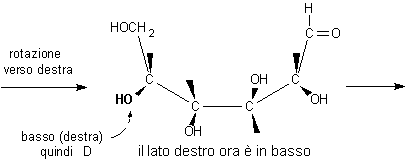
La testa e la coda della molecola vengono ora avvicinate: la struttura ciclica comincia a prendere forma. Prima di poterla chiudere è necessario però ruotare il C-5 per portare nel piano dell'anello l'OH che deve reagire con il gruppo aldeidico.
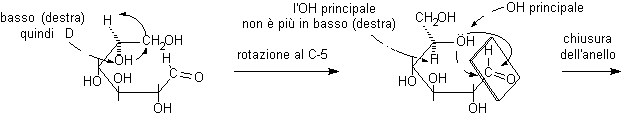
La rotazione al C-5 ha tolto l'OH principale dalla sua posizione in basso (destra), mentre ha portato il CH2OH terminale in alto (sinistra) dalla parte opposta a quella che spettava all'OH principale. La chiusura del semiacetale porta alla formazione degli anomeri a e b.
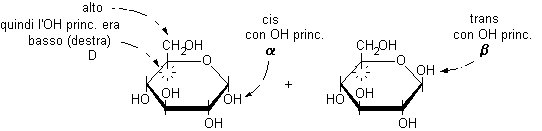
a-D-glucopiranosio................. b-D-glucopiranosio
L'OH principale è coinvolto nel legame semiacetalico e si trova nel piano dell'anello e quindi non è più diretto verso il basso (destra) nel posto che gli spettava nella proiezione di Fischer e non può essere utilizzato per attribuire la configurazione assoluta D. Quando questo accade, si può decidere la configurazione osservando che la posizione che spettava all'OH principale è sul lato opposto a quella occupata dal gruppo terminale CH2OH, in questo caso è in basso (destra) quindi la configurazione è D. L'anomero a può essere riconosciuto osservando che ha l'OH anomerico in cis rispetto all'OH principale (o alla posizione che spettava all'OH principale).
Riassumendo, il carbonio asimmetrico principale in uno zucchero della serie D deve avere:
Inoltre il carbonio anomerico a nei furanosi e nei piranosi (sia D che L) deve avere:
Seguono ora alcuni esempi di monosaccaridi disegnati secondo la proiezione di Haworth.
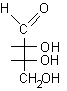 ....
.... .....................................
.....................................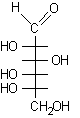
D-eritrosio..............b-D-eritrofuranosio .................................................L-glucosio .................a-L-glucopiranosio.........
 ,,,,,
,,,,,
D-ribosio ...................a-D-ribofuranosio.......
Come trasformare una struttura di Fischer
in una di Haworth
1) In questo esempio
vogliamo ottenere un b-piranosio
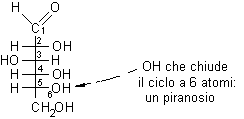
a partire dal D-glucosio. Per prima cosa
bisogna numerare la catena del glucosio fino a identificare l'OH che
chiude l'anello. L'OH che chiude il ciclo a sei atomi è quello sul C-5,
l'OH principale.
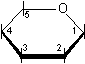
2) Disegnare la struttura dell'anello piranosidico secondo la proiezione di Haworth e numerare la catena di atomi di carbonio.
3) Trascrivere i gruppi OH dalla struttura di Fischer a quella di Haworth. Gli OH che si trovano a destra in Fischer vanno posti in basso nella struttura di Haworth. L'OH principale sul C-5 non va trascritto dato che è coinvolto nel legame semiacetalico. Scrivere quindi solo gli OH sui carboni 2, 3 e 4.
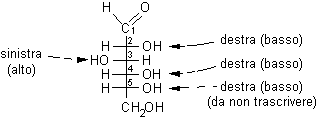
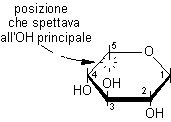
4) Scrivere ora il CH2OH terminale che va posto sul C-5 dalla parte opposta a quella che spettava all'OH principale, quindi verso l'alto.
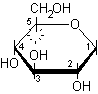
5) Infine va disegnato l'OH anomerico sul C-1, il nuovo centro asimmetrico. In questo caso, dato che vogliamo ottenere l'anomero b, l'OH va posto in trans rispetto alla posizione che spettava all'OH principale, cioè va posto sopra.
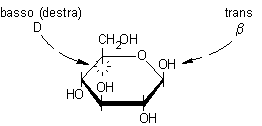
b-D-glucopiranosio
Proiezioni conformazionali
Le proiezioni di
Haworth descrivono meglio la struttura tridimensionale degli zuccheri rispetto
a quelle di Fischer, ma sono in ogni caso una semplificazione. Per avere una
rappresentazione più accurata si utilizzano le proiezioni conformazionali
che rappresentano i piranosi come strutture a sedia e i furanosi come
strutture a busta. In questo modo è possibile valutare meglio
i dettagli strutturali distinguendo i legami assiali da quelli equatoriali.
Le considerazioni fatte con le proiezioni di Haworth a proposito di forme D
e L, anomeri a e
b valgono anche
per le proiezioni conformazionali. Per convenzione l'ossigeno semiacetalico
va disegnato in alto e il carbonio anomerico a destra.
 ......
......
D-glucosio ...................................a-D-glucopiranosio .......................b-D-glucopiranosio
Seguono ora alcuni esempi di monosaccaridi disegnati secondo le proiezioni conformazionali.
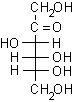 ...
... 
D-fruttosio .............................a-D-fruttopiranosio ....................a-D-fruttofuranosio.............
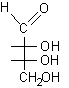 ...
... ................................
................................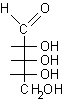
D-eritrosio.............. b-D-eritrofuranosio ............................................D-ribosio ..............a-D-ribofuranosio......
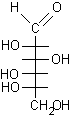 ...
...
L-glucosio ............................a-L-glucopiranosio..................
L'enantiomero, cioè la molecola speculare, del b-D-glucopiranosio è il b-L-glucopiranosio, quindi gli anomeri a e b non sono enantiomeri, ma diastereoisomeri infatti differiscono nella configu-razione di un solo centro asimmetrico, mentre sono identici nel resto della molecola.
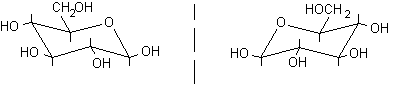
b-D-glucopiranosio .....specchio ......b-L-glucopiranosio
Come trasformare una struttura conformazionale
in una di Fischer
Uno zucchero disegnato in proiezione di Haworth o conformazionale può
essere riconosciuto trascrivendolo in struttura di Fischer aperta. Si procede
come segue:
1) Identificare il carbonio semiacetalico osservando che è l'unico al quale sono legati contemporaneamente due ossigeni. Se la molecola è scritta in modo standard, questo deve essere il carbonio a destra.
2) Attribuire la numerazione alla catena principale assegnando il numero più basso possibile al carbonio semiacetalico. Se questo è il C-1, allora la molecola è un aldoso, se è il C-2 si tratta di un chetoso. Il seguente monosaccaride, per esempio, è un aldoso con 6 atomi di carbonio.
......................
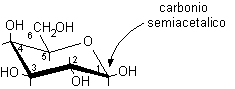
3) Disegnare la struttura di Fischer senza gli OH sui carboni chirali. In questo caso, disegnare la struttura di un aldoso con 6 atomi di carbonio: un aldoesoso.
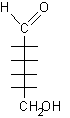
4) Trascrivere i gruppi OH dalla struttura conformazionale a quella di Fischer. Gli OH che si trovano in basso nella struttura conformazionale vanno posti a destra in quella di Fischer. La posizione che compete all'OH principale nell'anello è sul C-5, dalla parte opposta rispetto al CH2OH terminale.
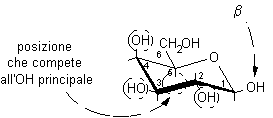 ..........................
..........................
Posizione dei quattro OH ................................................2-sotto,
3-sopra ..............................2-destra,
3-sinistra
su C-2, C-3, C-4, C-5 ......................................................4-sopra,
5-sotto.............................. 4-sinistra,
5-destra
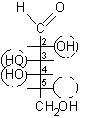
5) Scrivere l'OH principale nella struttura di Fischer, in questo caso va posto a destra dato che la posizione che gli competeva era sotto nella proiezione conformazionale. Questo OH non era presente come tale nella struttura ciclica perché era coinvolto nel legame semiacetalico, costituiva l'ossigeno eterociclico. Lo zucchero ottenuto è D-galattosio, quindi lo zucchero dato era b-D-galattopiranosio.
 ........................
........................ 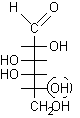
.............b-D-galattopiranosio ...........................D-galattosio
Proiezioni non convenzionali
Finora abbiamo considerato
sempre piranosi e furanosi disegnati con proiezioni di Haworth o conformazionali
di tipo standard, cioè con il carbonio anomerico a destra
e l'ossigeno eterociclico in alto. Quando si incontrano proiezioni non
convenzionali come quella nella figura seguente, può essere difficile
riconoscere la struttura di un monosaccaride ed attribuire la configurazione
D/L e /. In questi casi è necessario trasformare la proiezione non
conven-zionale in una proiezione standard e su questa poi riconoscere la
configurazione D o L, o b.
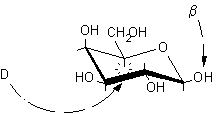
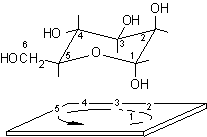
Dato il seguente monosaccaride disegnato in proiezione non standard si procede come segue.
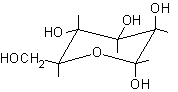
Proiezione conformazionale non standard
1) Identificare il carbonio semiacetalico osservando che è l'unico al quale sono legati contempo-raneamente due ossigeni.
2) Attribuire la numerazione alla catena principale assegnando il numero più basso possibile al carbonio semiacetalico.
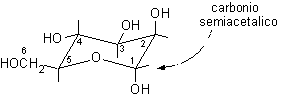
3) Disegnare l'anello piranosidico senza sostituenti, secondo la proiezione conformazionale standard e numerare la catena di atomi di carbonio.
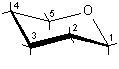
 ......................
......................
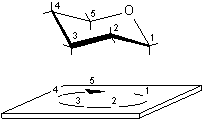
rotazione a sinistra ..........................................rotazione a destra
5) Le rotazioni osservate sono opposte, questo significa che la molecola non convenzionale è disegnata capovolta rispetto a quella standard. Quindi, nella nuova struttura, si devono trascrivere i gruppi ossidrilici OH dalla parte opposta rispetto al piano molecolare. Gli OH che si trovavano sotto vanno trascritti sopra e viceversa.
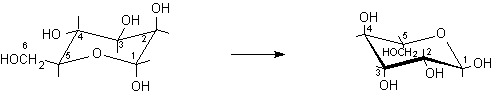
1-sotto, 2-sopra, 3-sopra, 4-sotto, 5-sopra ................1-sopra, 2-sotto, 3-sotto, 4-sopra, 5-sotto
6) La proiezione standard ottenuta va trasformata in proiezione di Fischer per assegnarle un nome:
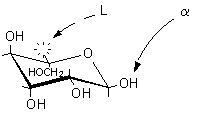
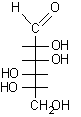
a-L-mannopiranosio ....................L-mannosio..
Il seguente esempio può chiarire ulteriormente il procedimento:
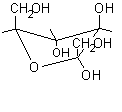 ................
................
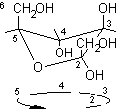 .................
.................
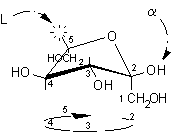 ...................
...................
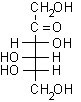
Proiezione conformazionale
...........................................................a-L-fruttofuranosio
.................................L-fruttosio ..........
non standard.......................................................................................................................................................
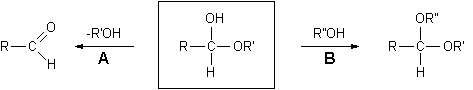
Reazioni dei semiacetali
Le reazioni più importanti dei semiacetali sono:
A) Idrolisi del semiacetale con scissione del legame etereo per tornare all'aldeide libera.
aldeide........................... semiacetale................................ acetale
Queste due reazioni avvengono facilmente in condizioni blande mentre sappiamo che eteri e alcoli sono molecole relativamente stabili. Infatti gli eteri danno scissione solo se trattati con HI concentrato a 130°C, gli alcoli si disidratano formando gli eteri solo se trattati con H2SO4 concentrato a 140°C. La particolare facilità con cui avvengono invece le reazioni A e B nei semiacetali in ambiente acido è dovuta al fatto che i due ossigeni, alcolico ed etereo, sono presenti contemporaneamente sullo stesso atomo di carbonio e quindi ciascuno dei due può stabilizzare per risonanza il carbocatione intermedio che si forma quando l'altro esce o come alcol o come acqua. In pratica ciascuno dei due facilita l'uscita dalla molecola dell'altro. Negli alcoli e negli eteri il carbocatione non è stabilizzato e questo spiega le differenze di reattività osservate con i semiacetali. Si osservi che l'idrolisi del legame etereo semiacetalico, che dà luogo all'aldeide libera, può avvenire anche con catalisi basica, dato che in ambiente basico può essere strappato l'H+ del gruppo alcolico e l'O- che rimane spinge in modo più efficace fuori dalla molecola il gruppo RO- per riformare l'aldeide libera. D'altro canto né la formazione né l'idrolisi dell'acetale è possibile in ambiente basico perché non ci sono H+ da poter strappare sull'ossigeno etereo, è per questo che gli acetali sono labili agli acidi, ma stabili alle basi.
1) catalisi acida
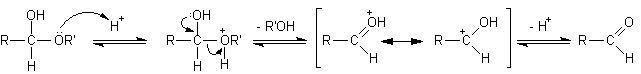
.aldeide...............................................
2) catalisi basica
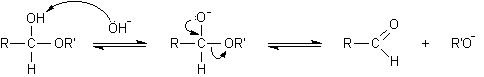
aldeide.............................................................................
B) Disidratazione e formazione dell'acetale
catalisi solo acida
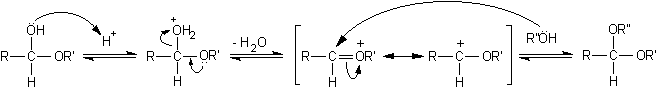
acetale.........................................
Chimica del glucosio
La chimica del glucosio è caratterizzata dalla
presenza del legame semiacetalico, infatti la maggior parte delle reazioni del
glucosio avvengono o sull'aldeide libera, dopo apertura dell'anello, o per sostituzione
dell'OH anomerico.
1) Reazioni sull'aldeide libera. Il glucosio, dopo l'apertura dell'anello, può dare le reazioni tipiche delle aldeidi. Tra queste ricordiamo le ossidazioni (ad eccezione di quella con Br2), le reazioni con fenilidrazina, gli allungamenti e gli accorciamenti di catena.
L'apertura dell'anello con scissione del legame etereo semiacetalico può avvenire con catalisi sia acida che basica, di seguito sono illustrati i meccanismi.
Catalisi acida
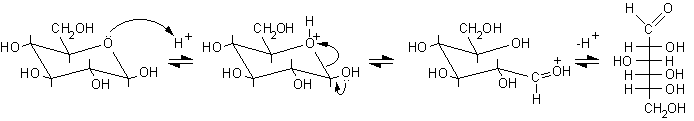
Catalisi basica
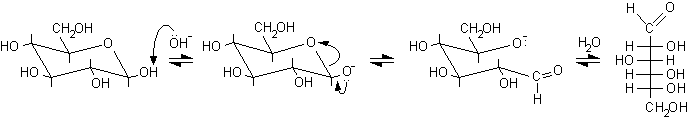
2) Reazioni con sostituzione dell'OH anomerico.
Queste reazioni possono avvenire dopo disidratazione del semiacetale. Tra queste ricordiamo le reazioni di formazione dei glicosidi. Si può avere l'ingresso di un gruppo alcolico come nei polisaccaridi o di un gruppo amminico come negli acidi nucleici. Il meccanismo della formazione del metil-glucopiranoside è il seguente e prevede la formazione di un carbocatione intermedio, stabilizzato per risonanza, a forma di mezza sedia. La catalisi è solo acida.
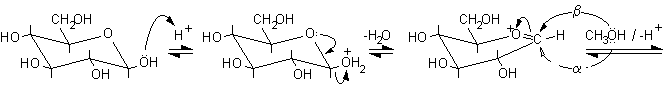
Carbocatione stabilizzato per risonanza.......................................
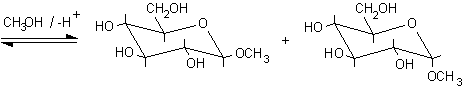
........................b-D-metilglucopiranoside ...........a-D-metilglucopiranoside
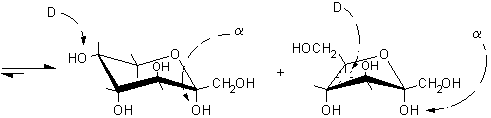
Si è formata, naturalmente, una miscela di b e a metilglucopiranoside dato che l'attacco al carbocatione intermedio può avvenire sia da sopra che da sotto il piano molecolare. In natura, invece, queste reazioni non sono lasciate al caso, ma sono condotte da enzimi specifici. Per esempio, nella sintesi del glicogeno, l'UDP-glucosio (uridina difosfato glucosio) viene idrolizzato e trasformato nel carbocatione intermedio a forma di mezza sedia, questo può reagire solo con il lato inferiore della molecola dato che si trova legato nel sito attivo dell'enzima che rende inaccessibile l'altra faccia. Così per reazione con l'OH, legato al C-4 terminale di una catena di glicogeno in accrescimento, si ottengono solo legami di tipo alfa, come è illustrato nella figura seguente.
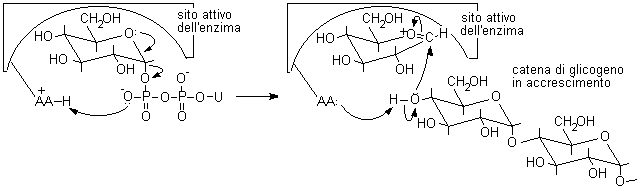
L'amminoacido protonato AAH+........................... L'amminoacido
AA si riprotona e attiva...........
favorisce la formazione del ....................................l'ossigeno
sul C-4 terminale del glicogeno.......
..carbocatione intermedio sul glucosio.................. che
attacca da sotto il carbocatione intermedio
Mutarotazione
I due anomeri a
e b del D-glucosio
sono diastereoisomeri e quindi è possibile separarli dato che hanno proprietà
chimico-fisiche diverse. La tecnica più semplice è la cristallizzazione:
il glucosio precipita a temperatura ambiente da soluzioni acquose concentrate
formando cristalli che hanno un punto di fusione di 146°C e potere rotatorio
specifico +112°. L'analisi strutturale con diffrazione di raggi X ha dimostrato
che questi cristalli contengono solo l'anomero a-D-glucopiranosio.
L'anomero b, in forma pura, si può ottenere per cristallizzazione del D-glucosio in acido acetico. Il b-D-glucopiranosio che si forma ha punto di fusione 150°C e potere rotatorio specifico +18,7°.
Sciogliendo in acqua a-D-glucopiranosio puro, si osserva che il potere rotatorio specifico della soluzione, che all'inizio è di +112°, non rimane costante, ma scende lentamente nel tempo fino ad un valore di +52,5°, caratteristico delle soluzioni di D-glucosio nelle quali sono presenti all'equilibrio i due anomeri a e b. La stessa cosa accade sciogliendo in acqua b-D-glucopiranosio, cioè si osserva che il potere rotatorio specifico non rimane costante, ma aumenta lentamente da +18,7° a +52,5°. Questa variazione del potere rotatorio è conosciuta come mutarotazione ed è dovuta alla isomerizzazione dell'anomero puro che si trasforma in una miscela di anomeri a e b nella quale i due anomeri sono presenti all'equilibrio. Questa reazione avviene lentamente in acqua pura, ma può essere accelerata con catalisi acida o basica. Il fenomeno della mutarotazione dimostra che il legame etereo semiacetalico si idrolizza facilmente anche in acqua pura formando piccole quantità di aldeide libera. Quando l'anello si richiude, l'OH in posizione 5 può attaccare l'aldeide da sopra o da sotto il piano molecolare sp2 formando una miscela di a e b-D-glucopiranosio di composizione fissa indipendentemente dalla forma che era stata sciolta inizialmente in acqua. La miscela di equilibrio contiene circa il 36% dell'anomero a, il 64% dell'anomero b e soltanto lo 0,02% della forma aldeidica libera.
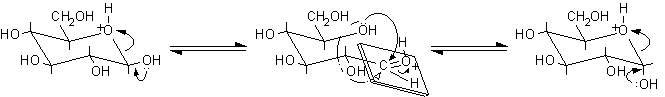
b-D-glucopiranosio .................aldeide
libera: l'OH può attaccare ...............a-D-glucopiranosio
64% (+18,7°) .......................da
sopra o da sotto 0,02% .............................36%
(+112°)
Formazione degli osazoni
I monosaccaridi
esistono prevalentemente nella forma ciclica semiacetalica, ma esiste sempre
all'equilibrio una piccola percentuale di aldeide libera, come è dimostrato
dalla mutarotazione, grazie alla facile scissione del legame etereo semiacetalico.
Il gruppo aldeidico libero di un monosaccaride può reagire con i reagenti
tipici del gruppo carbonilico come fenilidrazina, idrossilammina e acido cianidrico.
Qui esaminiamo la reazione dei monosaccaridi con fenilidrazina. Se questa
viene condotta a freddo con una mole di fenilidrazina, si formano i fenilidrazoni,
che però, essendo solubili in acqua, sono di scarso interesse ai fini
della loro separazione e identificazione. Se invece i monosaccaridi vengono
fatti reagire a 100 °C con un eccesso di fenilidrazina (3 moli) si ottengono
i difenilidrazoni chiamati osazoni che sono solidi cristallini, poco
solubili in acqua fredda, con punti di fusione caratteristici. La reazione è
interessante in quanto si assiste alla ossidazione dell'ossidrile adiacente
al gruppo carbonilico e alla riduzione di una molecola di fenilidrazina ad ammoniaca
e anilina.
Consideriamo per esempio il D-glucosio. La reazione inizia con l'attacco della
fenilidrazina al gruppo aldeidico libero che porta alla formazione del fenilidrazone.
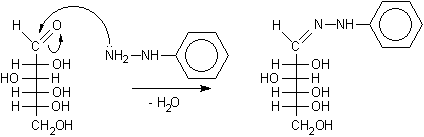
D-glucosio, forma aldeidica........................ fenilidrazone del D-glucosio
Questo, in presenza di un eccesso di fenilidrazina, può tautomerizzare producendo piccole quantità di una molecola simile all'enediolo. Quest'ultima, attraverso un arrangiamento ciclico a sei atomi, dà luogo ad una ossidoriduzione interna. Si ossida il C-2 formando un carbonile, mentre i due atomi di azoto vengono ridotti ed uno viene eliminato come anilina.
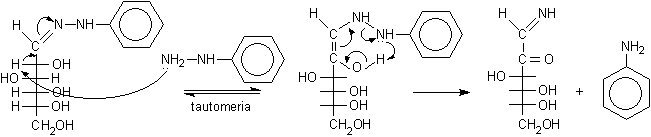
fenilidrazone ......................................intermedio simile all'enediolo.............................................
La molecola che si ottiene è un chetone sul C-2 e un'immina sul C-1 e può quindi reagire con altre due molecole di fenilidrazina portando all'osazone.
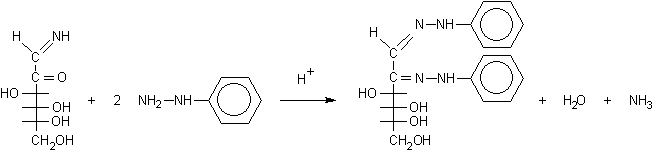
........................................osazone
Si noti che viene ossidato un solo gruppo ossidrilico, quello adiacente al carbonile, la fenilidrazina non è in grado di continuare l'ossidazione lungo la catena. La sintesi degli osazoni ha avuto una notevole importanza, dal punto di vista analitico, infatti gli osazoni sono composti facilmente cristallizzabili e purificabili con un punto di fusione caratteristico, mentre le soluzioni zuccherine tendono a formare degli sciroppi difficilmente purificabili per cristallizzazione. Dato che l'uso principale degli osazoni è l'identificazione dei monosaccaridi di partenza, essi presentano un inconveniente: il centro asimmetrico sul C-2 dello zucchero originale viene perduto. Riconoscere l'osazone di un aldoso sconosciuto, attraverso il suo punto di fusione, consente almeno di limitare il campo di indagine ai due soli aldosi epimeri sul C-2 che danno quell'osazone. (Per definizione due monosaccaridi che differiscono per la configurazione di un solo centro asimmetrico vengono chiamati epimeri).
Due aldosi epimeri sul C-2, come D-glucosio e D-mannosio, danno quindi lo stesso osazone, con punto di fusione 205 °C, dato che hanno la stessa configurazione ai carboni C-3, C-4, C-5.
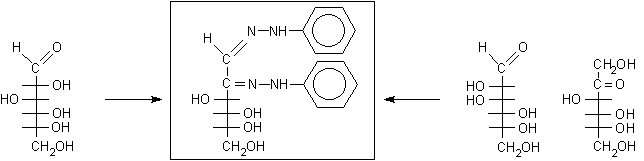
D-glucosio .............................osazone (p.f. 205 °C) ..........................D-mannosio ..........D-fruttosio
Anche un chetoesoso, il fruttosio, dà lo stesso osazone di glucosio e mannosio. Questo dimostra che il fruttosio ha la stessa configurazione al C-3, C-4, C-5 di glucosio e mannosio, inoltre dimostra che nel fruttosio, durante la sintesi dell'osazone, si ossida sempre il carbonio primario C-1 piuttosto di quello secondario C-3. Il carbonio primario, infatti, regge meglio la carica negativa nello stato di transizione per la formazione dell'enediolo.
Accorciamento della catena: degradazione
di Wohl
Per accorciare la
catena di atomi di carbonio di un aldoso, il metodo più usato è
la degradazione di Wohl. Questa è costituita da una sequenza di 5 reazioni
che qui vengono illustrate nel caso del D-glucosio. La degradazione inizia con
la reazione del gruppo aldeidico libero del D-glucosio con idrossilammina
per ottenere la corrispondente ossima. Questa viene poi disidratata
a nitrile con anidride acetica. Non si può usare un disidratante
troppo forte come SOCl2
che trasformerebbe tutti gli ossidrili in cloruri alchilici distruggendo in
modo irreversibile la molecola. Con anidride acetica gli ossidrili vengono
acetilati, cioè convertiti in esteri dell'acido acetico che poi possono
essere facilmente idrolizzati.
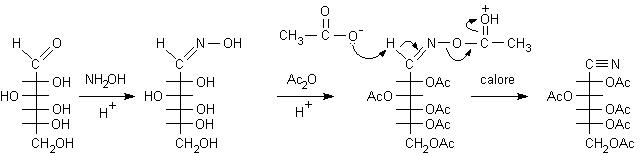
.............D-glucosio ...................ossima ......................................ossima acetilata................. cianidrina acetilata
Gli esteri acetici presenti sulla cianidrina acetilata si devono idrolizzare in ambiente basico anidro con metossido di sodio in metanolo per evitare la contemporanea idrolisi del nitrile che avverrebbe facilmente in ambiente acquoso. La cianidrina ottenuta non è stabile in ambiente basico e tende ad eliminare il gruppo CN- dando luogo all'aldeide con un carbonio in meno. Questa reazione può essere spinta a completezza con Ag2O dato che Ag+ sottrae all'equilibrio gli ioni CN- precipitando sotto forma di AgCN bianco.
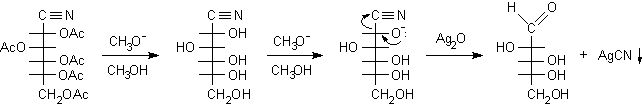
cianidrina acetilata................. cianidrina............................................................ D-arabinosio.....................
Si è ottenuto D-arabinosio un aldopentoso che ha un carbonio in meno nella catena rispetto al D-glucosio. Il C-1 del glucosio è stato perso sotto forma di acido cianidrico dalla cianidrina intermedia. La cianidrina è la molecola chiave della degradazione di Wohl in quanto dalla cianidrina è possibile ottenere l'aldeide con un carbonio in meno. E' importante osservare che questo equilibrio, a seconda del pH, può essere spostato facilmente in una direzione o nell'altra tanto che la cianidrina è l'intermedio chiave sia nella degradazione che nella reazione opposta di allungamento di catena.
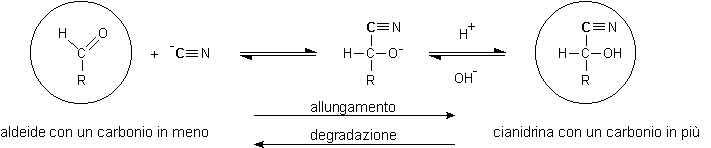
Allungamento della catena: sintesi di Kiliani-Fischer
La sintesi di Kiliani-Fischer
permette di allungare di una unità la catena di atomi di carbonio in
un aldoso. La sintesi inizia con la reazione del gruppo aldeidico libero dell'aldoso
con acido cianidrico per formare la cianidrina con un carbonio in più.
Si ottengono le due cianidrine epimere sul C-2, infatti lo ione CN- che
attacca l'aldeide può portare l'attacco da sopra o da sotto il piano
molecolare sp2
dando origine a due opposte configurazioni sul C-2. Le cianidrine vengono poi
idrolizzate ai rispettivi acidi gliconici. Con il D-arabinosio avremo:
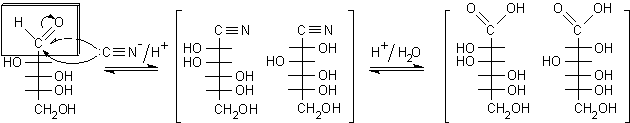
....D-arabinosio.........................
cianidrine epimere..........................
acido mannonico e gluconico
5C
................................................ 6C
...............................................................6C.........
La riduzione controllata dell'acido carbossilico ad aldeide presenta delle difficoltà per la nota tendenza delle aldeidi a ridursi direttamente fino ad alcol. Dato che è impossibile trasformare gli acidi gliconici in cloruri acilici senza disidratare anche i gruppi ossidrilici, non si possono utilizzare le normali riduzioni selettive (come quella di Rosemund con H2 e palladio disattivato) che si applicano solo ai cloruri acilici, più reattivi delle aldeidi. Il problema è stato risolto da Fischer trattando, prima della riduzione, l'acido gliconico in ambiente acido ed evaporando il solvente. In questo modo l'acido gliconico si disidrata formando il g-lattone, cioè l'estere ciclico con anello furanosidico.
La riduzione del gruppo carbonilico del lattone non produce l'aldeide libera, ma il semiacetale e quindi la riduzione per il momento non può proseguire. La successiva riduzione fino ad alcol può essere evitata data la piccolissima percentuale di aldeide libera presente all'equilibrio, a patto di mantenere sempre molto bassa la concentrazione del riducente, NaBH4, che viene versato goccia a goccia. Per semplicità seguiamo la reazione per il solo acido mannonico.
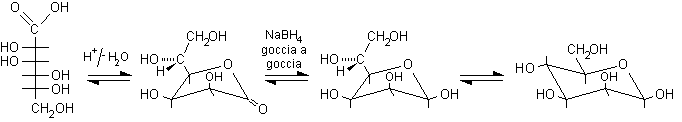
ac. mannonico .........D-mannono-g-lattone ............D-mannofuranosio ................D-mannopiranosio......
In conclusione, l'allungamento di catena di Kiliani-Fischer del D-arabinosio produce due esosi epimeri, D-glucopiranosio e D-mannopiranosio. Di ciascuno si ottengono i due anomeri a e b.
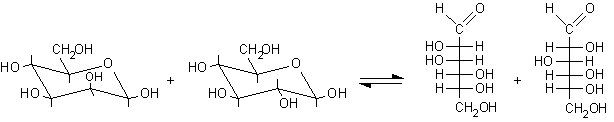
.......D-mannopiranosio............. D-glucopiranosio .......................D-mannosio....... D-glucosio
Isomerizzazione
alcalina
Aldosi ed esosi se vengono trattati con basi forti, subiscono isomerizzazione
e danno una miscela di monosaccaridi isomeri. Questa è una reazione generale
a cui sottostanno tutte le alfa idrossi aldeidi e gli alfa idrossi chetoni.
La reazione passa attraverso la formazione di un intermedio instabile chiamato
enediolo dato che ha due ossidrili legati allo stesso doppio legame. Il meccanismo
è identico a quello di formazione dell'enolo nella tautomeria cheto-enolica.
Nel caso del D-glucosio si ha:
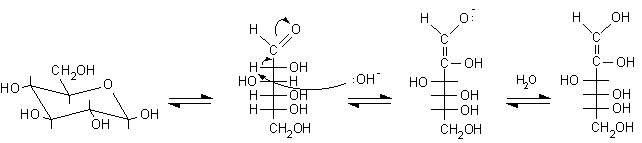
D-glucopiranosio .................D-glucosio (forma aperta) ...........................................enediolo
Si noti che nell'enediolo si è persa la stereochimica del C-2 tipica del glucosio e quindi l'enediolo può tornare indietro a uno qualunque dei tre composti idrossicarbonilici possibili: D-glucosio, D-mannosio e D-fruttosio. Se ora il carbonile si forma sul C-2 si ottiene fruttosio, se il carbonile si forma sul C-1 si può ottenere glucosio o mannosio perché l'H+ si può legare sopra o sotto il piano molecolare sp2 dell'enediolo.
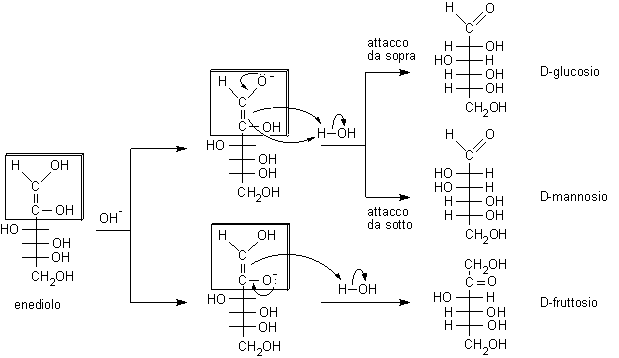
L'isomerizzazione alcalina del glucosio produce una miscela nella quale sono presenti glucosio, mannosio e fruttosio in equilibrio tra loro attraverso l'intermedio instabile enediolo. Proprio perché si tratta di un equilibrio, si ottiene sempre la stessa miscela finale partendo da uno qualunque di questi tre monosaccaridi. Anche qui, come nella reazione di preparazione degli osazoni, il fruttosio forma l'enediolo tra C-1 e C-2 piuttosto che tra C-2 e C-3. Dato che lo stato di transizione per la formazione dell'enediolo ha carattere carbanionico, il carbonio primario C-1 regge meglio la parziale carica negativa rispetto al C-3 secondario.
E' interessante confrontare questa reazione, che avviene in soluzione alcalina, con la stessa reazione catalizzata da enzimi che ha un andamento diverso. Nella cellula l'isomerizzazione del glucosio è condotta dall'enzima glucosio-fruttosio isomerasi che catalizza l'isomerizzazione di questi due soli zuccheri senza la contemporanea formazione di mannosio.
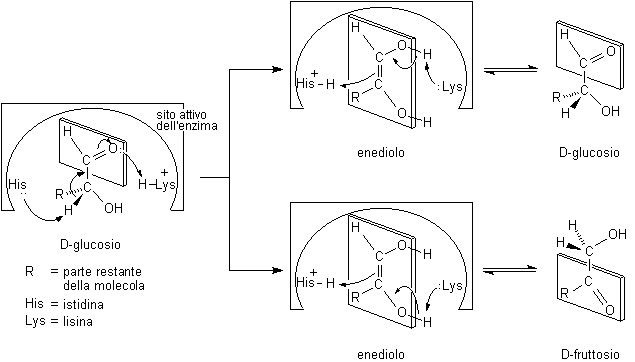
Questo fatto può essere compreso osservando che nel sito attivo dell'enzima, che ospita la molecola del glucosio, è presente l'amminoacido istidina (His) che è in grado di guidare l'H+ fuori dal glucosio e poi verso l'enediolo sempre dalla stessa parte. In questo modo l'H+ non può mai entrare da dietro il piano molecolare dell'enediolo e quindi risulta impossibile la formazione di mannosio. Quando l'isomerizzazione avviene in soluzione alcalina, invece, le molecole sono orientate in modo casuale e quindi l'H+ può entrare indifferentemente da sopra o da sotto il piano molecolare dell'enediolo.
In conclusione, possono subire isomerizzazione alcalina le alfa idrossi aldeidi e gli alfa idrossi chetoni perché è necessario che sia presente un gruppo ossidrilico in posizione alfa rispetto al carbonile per dare luogo all'enediolo.
Esercizio: scrivere la reazione di isomerizzazione dell'1,3-diidrossi-acetone.
Ossidazione
L'ossidazione degli zuccheri può essere condotta sia in ambiente
basico che in ambiente acido. Mentre l'ossidazione in ambiente alcalino è
utilizzata solo per scopi analitici, quella in ambiente acido è utilizzata
sia a scopo analitico che preparativo. Una blanda ossidazione degli aldosi produce
i corrispondenti acidi carbossilici chiamati acidi gliconici, un'ossidazione
più energica produce gli acidi dicarbossilici chiamati acidi glicarici.
Ossidazione in ambiente basico
Esistono tre diversi reattivi per operare l'ossidazione alcalina degli aldosi e dei chetosi che vengono trasformati in acidi gliconici:
Reattivo di Fehling. E' composto
da due soluzioni A e B da mescolare al momento dell'uso. La soluzione A contiene
CuSO4. La
soluzione B contiene tartrato di sodio ed NaOH. Il tartrato ha la funzione di
complessare il Cu2+
che altrimenti precipiterebbe come idrossido. La specie ossidante è il
Cu2+ che si
riduce a Cu+
precipitando come ossidulo di rame Cu2O
rosso. 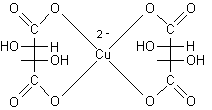 ................
................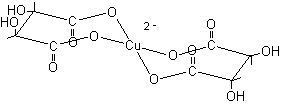
Complesso [Cu(II) (tartrato)2]2-
...............................proiezione conformazionale...............
coordinazione planare quadrata.............................................................................................
2) Reattivo di Benedict. E' identico al Fehling con la differenza che usa lo ione citrato al posto del tartrato ed è composto da una sola soluzione stabile nel tempo.
3) Reattivo di Tollens. E' composto da una soluzione ammoniacale di AgNO3 che contiene il complesso Ag(NH3)2+. La specie ossidante è lo ione Ag+ che si riduce ad Ag metallico e precipita sotto forma di specchio sulla superficie interna della provetta.
Questi tre reattivi permettono di eseguire dei saggi qualitativi (talora anche quantitativi) per determinare se un certo zucchero è ossidabile in condizioni basiche. Uno zucchero che reagisce positivamente a questi saggi viene definito zucchero riducente. Il gruppo aldeidico dello zucchero viene ossidato e si forma un acido carbossilico chiamato acido gliconico. Dato però che l'ossidazione avviene in ambiente basico, possono reagire anche molecole che non contengono inizialmente il gruppo aldeidico, ma che lo possono generare per isomerizzazione alcalina. Ecco perché possono reagire oltre alle aldeidi come il D-glucosio anche gli alfa-idrossichetoni come il fruttosio che viene prima isomerizzato a glucosio e mannosio e poi, sotto questa forma, può essere ossidato ad acido gluconico e mannonico.
Gli aldosi e i chetosi vengono ossidati anche se sono impegnati nel legame semiacetalico dato che questo viene idrolizzato velocemente in ambiente basico. Invece gli zuccheri impegnati in legami acetalici (glicosidici) non reagiscono perché gli acetali sono stabili alle basi e non liberano l'aldeide o il chetone e sono quindi chiamati zuccheri non riducenti.
Riassumendo, sono zuccheri riducenti sia gli aldosi sia i chetosi non impegnati in legami acetalici.
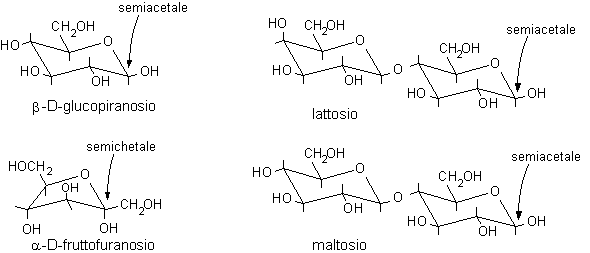
Zuccheri riducenti
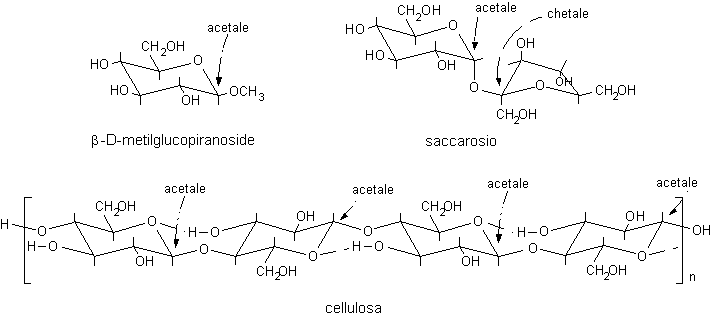
Zuccheri non riducenti
Viene ora illustrata la reazione del fruttosio con il reattivo di Fehling:
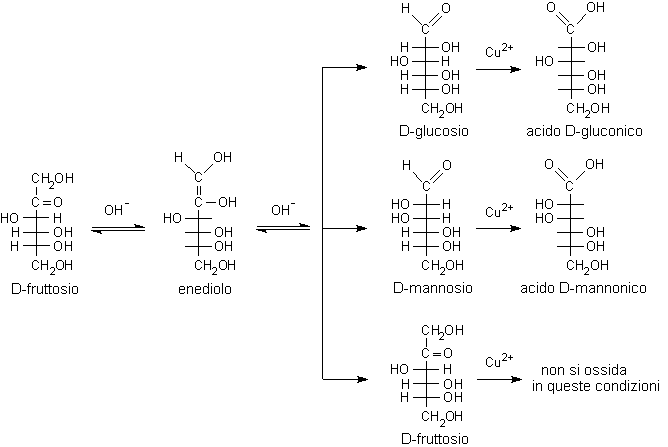
Ossidando il fruttosio si ottengono gli acidi gluconico e mannonico, gli stessi acidi che si sarebbero formati ossidando il glucosio oppure il mannosio. L'ossidazione in ambiente basico, a causa della isomerizzazione alcalina, fornisce sempre miscele di acidi gliconici e quindi non è utilizzabile per sintetizzare un acido gliconico a partire dal corrispondente aldoso.
Ossidazione in ambiente acido
con Br2
Gli acidi gliconici possono essere preparati in
modo pulito per ossidazione dei corrispondenti aldosi con acqua di bromo a pH
5. In queste condizioni i chetosi come il fruttosio non reagiscono dato che
non c'è isomerizzazione. Questo permette di utilizzare la reazione con
acqua di bromo anche a fini analitici per distinguere gli aldosi dai chetosi.
L'acido gliconico, per evaporazione del solvente in ambiente acido, si disidrata
e forma il g-lattone,
l'estere ciclico con anello furanosidico a 5 atomi che qui è mostrato
sia in proiezione di Fischer che conformazionale. (I lattoni sono più
stabili quando formano un ciclo a 5 termini piuttosto che a 6 come i semiacetali).
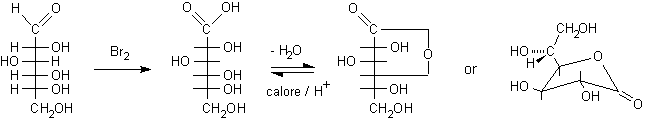
D-glucosio ....................acido D-gluconico................................. D-glucono-g-lattone.................
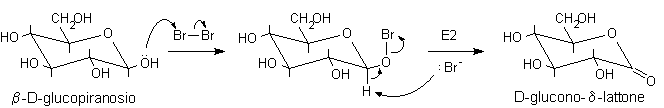
..Il meccanismo della reazione vede il glucosio reagire nella forma chiusa semiacetalica. L'ossigeno anomerico attacca dapprima il Br2 legandosi al Br+, in un secondo momento si ha eliminazione di HBr con formazione del d-lattone, l'estere ciclico con anello a 6 atomi.
Il glucono-d-lattone, instabile, si idrolizza liberando acido gluconico, che, per evaporazione del solvente in ambiente acido, può formare glucono-g-lattone.
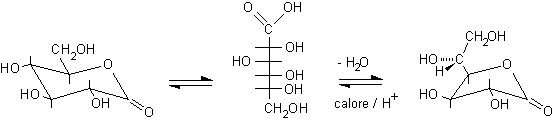
D-glucono-d-lattone ...................acido D-gluconico .................D-glucono-g-lattone
Il meccanismo qui proposto permette di spiegare un curioso dato sperimentale: l'anomero b del glucosio viene ossidato ad una velocità 200 volte maggiore dell'anomero a. Durante la reazione, infatti, nel b-D-glucopiranosio (vedi figura precedente) gli atomi H e Br possono facilmente assumere la conformazione anti, necessaria per l'eliminazione E2. Nell'anomero a, invece, l'atomo di bromo non può ruotare liberamente attorno all'ossigeno a causa dell'ingombro sterico degli idrogeni assiali e quindi non può raggiungere facilmente la conformazione anti mostrata in figura.
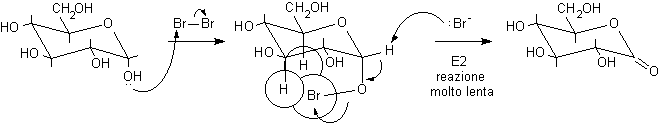
a-D-glucopiranosio............................................................................................. D-glucono-d-lattone
Ossidazione in ambiente
acido con HNO3
Ossidanti più forti, come HNO3
diluito caldo, ossidano, oltre al gruppo aldeidico, anche il gruppo ossidrilico
primario, più facilmente ossidabile di quelli secondari. Gli aldosi vengono
ossidati ad acidi dicarbossilici chiamati acidi glicarici. Questi, per evaporazione
del solvente in ambiente acido, possono formare i lattoni doppi.
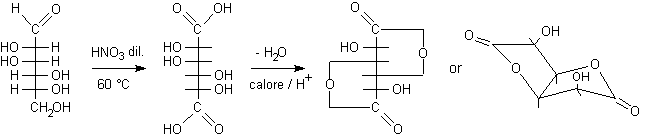
D-mannosio ..............acido D-mannarico.............................g-lattone doppio dell'acido mannarico......
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------.
Appunti di lezione del Prof. Mauro Tonellato - Itis Natta - Padova
.