|
|
Tripsina |
|||||
|
Molecola del mese di ottobre 2003 La tripsina è un enzima prodotto nel pancreas che taglia le proteine in corrispondenza degli amminoacidi basici 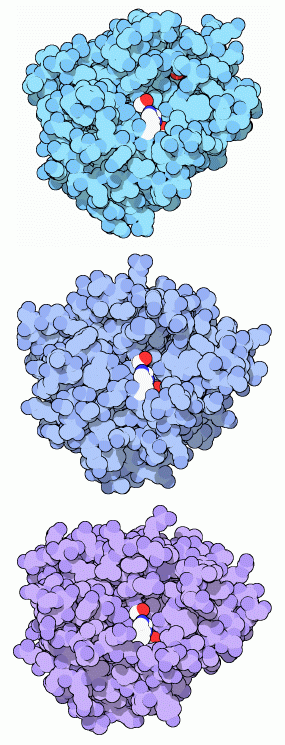 Introduzione IntroduzioneIl nostro corpo ha bisogno di un consistente apporto di amminoacidi che vengono usati per costruire nuove proteine o per sostituire quelle vecchie. Ogni giorno, un adulto ha bisogno di circa 35-90 grammi di proteine, a seconda del suo peso. Stranamente, però, molte di queste proteine le otteniamo dal nostro stesso corpo. Ogni giorno, infatti, produciamo 20-30 grammi di proteine digestive che vengono a loro volta digerite quando hanno finito il loro compito. Inoltre vengono digerite e riassorbite anche le cellule intestinali morte e le proteine presenti nelle piccole perdite di sangue, a dimostrazione del fatto che il nostro corpo è esperto nel riciclare le molecole. Forbici per proteine Le proteine sono molecole resistenti, così dobbiamo usare molti enzimi per digerirle cioè per tagliarle in pezzi sempre più piccoli fino a liberare gli amminoacidi di cui sono composte. La digestione delle proteine comincia nello stomaco, dove l'acido cloridrico le fa srotolare e l'enzima pepsina esegue i primi tagli. Il grosso del lavoro comincia però più avanti, nell'intestino. Il pancreas produce molti enzimi proteolitici, il più importante dei quali è la tripsina, che tagliano le catene proteiche in frammenti lunghi solo alcuni amminoacidi. Poi, altri enzimi, sulla superficie delle cellule intestinali e all'interno delle cellule, li tagliano in amminoacidi, che vengono usati in tutto il corpo per la sintesi di nuove proteine. Enzimi proteolitici alla serina La tripsina usa un particolare amminoacido, la serina, per eseguire la reazione di taglio delle proteine, e quindi è conosciuta come proteasi alla serina. Questa, in realtà, è una vasta famiglia di enzimi che usano un apparato enzimatico simile. Durante la digestione, tripsina, chimotripsina ed elastasi lavorano insieme per tagliare le proteine. Ognuna ha una sua particolare preferenza per le catene laterali di alcuni amminoacidi. La tripsina (mostrata qui a fianco in alto, file PDB 2ptn) taglia sul carbossile degli amminoacidi basici: lisina e arginina. La chimotripsina (mostrata qui a fianco in mezzo, file PDB 2cha) taglia sul carbossile dei grandi amminoacidi apolari: fenilalanina, tirosina, triptofano, leucina e isoleucina. L'elastasi (mostrata qui a lato, file PDB 3est) preferisce le catene laterali degli amminoacidi piccoli come alanina. Nelle tre immagini qui a destra, la serina chiave è mostrata in bianco e rosso al centro del sito attivo, vicino a lei si vede anche un'istidina (bianca e blu) ed un acido aspartico (in alto è visibile solo un suo ossigeno rosso). Enzimi simili alla tripsina si trovano anche in molti altri punti del nostro corpo. Alcuni di questi enzimi sono estremamente specifici, tagliano solamente una particolare proteina. Per esempio, la trombina (mdm 1-2002), taglia in modo specifico il fibrinogeno, creando così un coagulo di sangue. Enzimi robusti Le proteasi alla serina hanno avuto un ruolo centrale nella scoperta e nello studio degli enzimi. Si sono rivelati un soggetto ideale da studiare, perchè sono abbondanti nei succhi pancreatici e sono stabili e quindi sono facili da isolare. È anche facile studiare la loro funzione: basta introdurre una qualsiasi proteina e osservare quanto velocemente viene digerita. La chimotripsina è stata fra le prime proteine ad essere studiata con la cristallografia a raggi X, rivelando il suo complesso apparato per legare la proteina bersaglio e compiere un taglio preciso nella catena. Oggi, ci sono centinaia di strutture di proteasi alla serina disponibili nel PDB che aspettano solo di essere esplorate. I pericoli delle proteasi La digestione delle proteine nel nostro corpo è un'operazione molto delicata. Le proteine costituiscono circa un quinto del materiale presente nelle nostre cellule, così dobbiamo stare molto attenti quando costruiamo una macchina che le taglia a pezzi. Con gli enzimi digestivi, il problema è stato risolto sintetizzandoli inizialmente in una forma inattiva (zimogeni), che viene attivata solo dopo che l'enzima è giunto nell'intestino. La tripsina appena sintetizzata ha un tratto iniziale in più di 15 amminoacidi (che termina con lisina 15) nella catena proteica. Questa forma più lunga di tripsina, chiamata tripsinogeno, è inattiva e non può tagliare catene proteiche. Poi, quando entra nell'intestino, l'enzima enteropeptidasi taglia la piccola coda staccandola della tripsina. Nella struttura del tripsinogeno mostrata qui sotto a sinistra (file PDB 1tgn) questo tratto di 15 amminoacidi iniziali prosegue oltre il segmento giallo, ma non è stato registrato a causa della sua mobilità e quindi dovete immaginare questa catenella che sporge fuori dalla proteina. 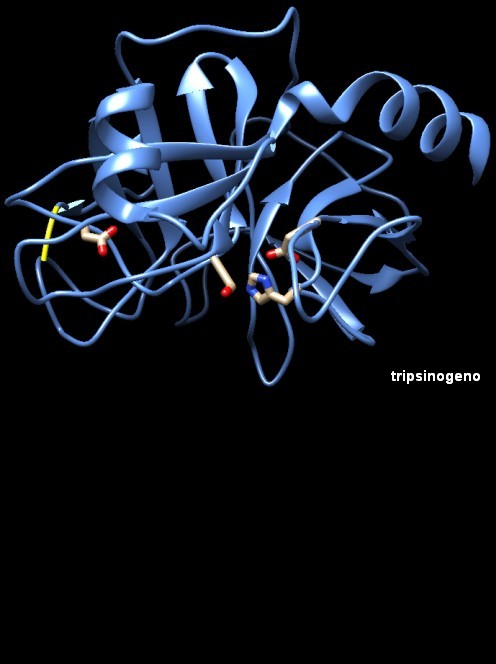
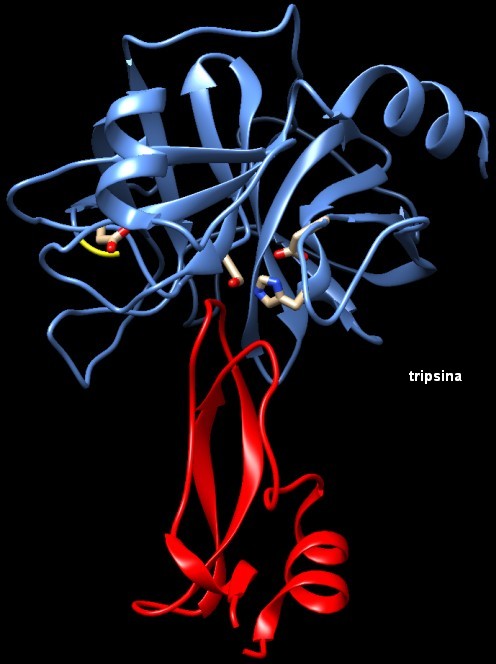
Nella tripsina, mostrata qui sopra sulla destra (file PDB 1p2i), dopo il taglio dei 15 amminoacidi iniziali, la nuova parte terminale della catena (gialla) può infilarsi all'interno della proteina per stabilizzare la forma attiva dell'enzima. Per maggior sicurezza, il pancreas sintetizza anche un inibitore della tripsina, la piccola proteina rossa mostrata qui sopra, che si lega ad eventuali tracce di tripsina attiva che potrebbero essere presenti nel pancreas prima che avvenga la secrezione nell'intestino. Questo inibitore si lega al sito attivo della tripsina, bloccandone l'azione temporaneamente, fino a quando, nell'intestino, sarà tagliato a pezzi da altri enzimi proteolitici. Confrontando le due strutture qui sopra di tripsinogeno e tripsina, si vede che, al centro, i tre amminoacidi del sito attivo, nell'ordine serina (195), istidina (57) e acido aspartico (102), conservano la loro posizione, mentre la porzione di catena sulla sinistra cambia struttura. Si tratta del sito di riconoscimento della proteina bersaglio dove è evidenziato un altro amminoacido, acido aspartico (189).  Esplorando
la struttura Esplorando
la strutturaNel PDB, ci sono molti altri esempi di proteasi alla serina, che vengono sintetizzate per la digestione, l'attivazione di ormoni, la coagulazione del sangue, l'attivazione del sistema immunitario, e per molte altre funzioni. Tutti questi enzimi hanno in comune un insieme di tre amminoacidi che si è rivelato molto efficiente nel taglio delle proteine al punto che è stato riscoperto più e più volte da organismi diversi nel corso dell'evoluzione. Il cuore di questa mecchina molecolare è un amminoacido serina che viene attivato da una istidina e da un acido aspartico. L'istidina e l'acido aspartico aiutano a rimuovere un atomo di idrogeno dalla serina (bianco), questa diventa più reattiva al momento di attaccare la proteina bersaglio. La figura qui a fianco (file PDB 2ptc) mostra una tripsina nell'atto di tagliare una proteina inibitrice (rosa) legata al sito attivo. Il sito di taglio (verde), però, è tenuto abbastanza lontano da non essere tagliato nel modo in cui lo sarebbero la maggior parte delle proteine nella stessa posizione. Notate anche la lunga catena laterale dell'amminoacido lisina che si estende verso il basso a destra dal sito di taglio (termina con un azoto blu), dove interagisce con un altro acido aspartico (189) dell'enzima (nell'angolo a destra in basso con gli ossigeni rossi). Attraverso questa interazione, la tripsina riconosce la lisina e può tagliare in corrispondenza del suo carbossile. Nell'immagine qui sotto (fatta con Chimera) è illustrato lo stesso sito attivo (file PDB 2ptc). Sulla sinistra si vede la tripletta catalitica: acido aspartico (Asp-102), istidina (His-57), serina (Ser-195). Al centro si vede la catena laterale della lisina (Lys) che viene riconosciuta dall'acido aspartico (Asp-189) sulla destra. La catena della proteina che deve essere tagliata è mostrata in magenta. . 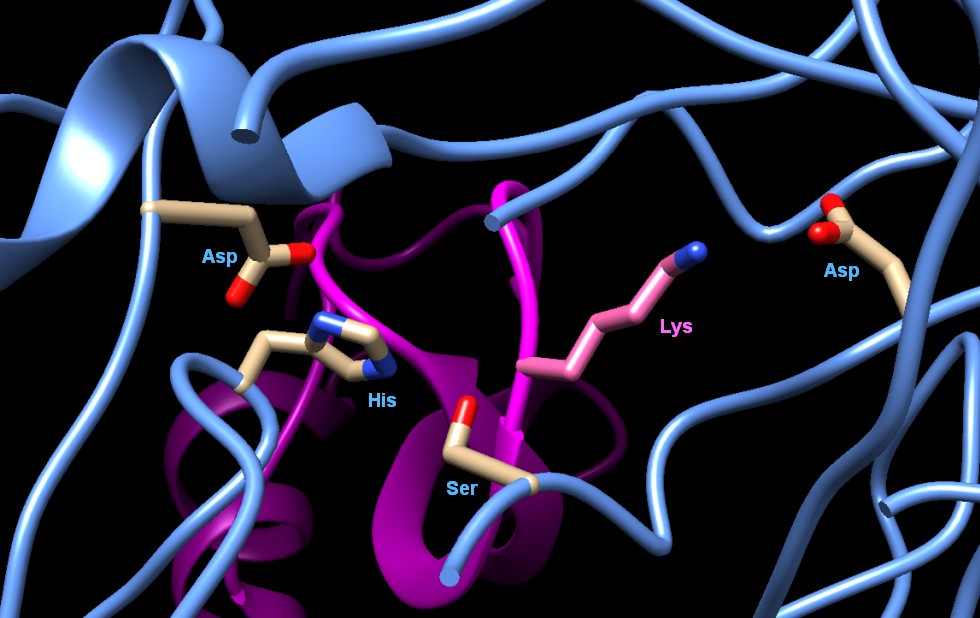 R.M. Stroud (1974): A Family of Protein-Cutting Proteins. Scientific American 231(1), pp. 74-88. R.H. Erickson and Y.S. Kim (1990): Digestion and Absorption of Dietary Protein. Annual Review of Medicine 41, pp. 133-139 .
|
||||||
|
|
||||||
