|
Molecola del mese di febbraio 2005
MHC espone all'esterno della cellula alcuni peptidi prodotti
all'interno e così consente al sistema immunitario di individuare
le cellule infette
 Introduzione Introduzione
I virus sono nemici insidiosi, per questo dobbiamo
avere più strategie difensive per combatterli in modo efficace.
Gli anticorpi sono la nostra prima linea di difesa, si legano
ai virus e inducono le cellule del sangue a distruggerli. Ma cosa accade
se i virus riescono ad eludere questa difesa ed entrano nelle cellule?
A questo punto gli anticorpi non hanno più la possibilità
di incontrarli ed i virus sono al sicuro... ma non completamente.
Ogni cellula nucleata ha una seconda linea di difesa che usa per
segnalare al sistema immunitario che c'è qualche cosa di sbagliato
al suo interno. Le cellule eliminano in continuazione le loro vecchie
proteine tagliandole in pezzi ed espongono poi alcuni di questi frammenti
sulla loro superficie. Questi piccoli peptidi si legano al MHC, il complesso
maggiore di istocompatibilità, che trattiene i peptidi e permette
al sistema immunitario di esaminarli. In questo modo, il sistema immunitario
può controllare quello che sta succedendo all'interno della cellula.
Se tutti i peptidi esposti sulla superficie della cellula sono normali,
il sistema immunitario la lascia in pace. Ma se c'è un virus che
si sta moltiplicando al suo interno, allora molte delle molecole del MHC
portano peptidi insoliti che provengono da proteine virali, e quindi il
sistema immunitario interviene uccidendo la cellula infettata.
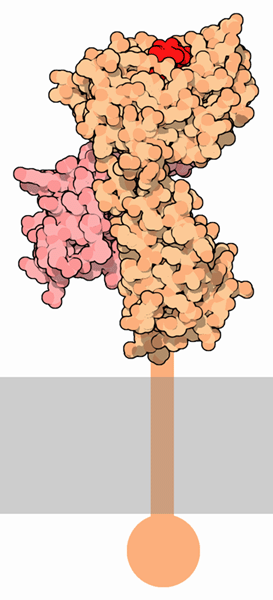
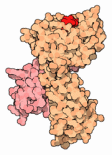
Esporre peptidi
Come molte proteine del sistema immunitario, MHC
è composto di più parti funzionali connesse da giunture
flessibili. La struttura mostrata qui a fianco (file PDB 1hsa)
mostra solo la parte che si trova all'esterno della cellula. La grande
catena arancione ha un incavo nella parte superiore che si lega al peptide
(rosso). Una catena più piccola (rosa) stabilizza la struttura.
Nella proteina completa, la catena arancione si estende verso il basso
e attraversa la membrana cellulare (grigia), ancorando la proteina alla
superficie della cellula. Questa porzione della molecola, però,
è troppo flessibile per essere studiata con la cristallografia
a raggi X e quindi è stata rimossa.
MHC in azione
L'azione urticante dell'edera velenosa è
causata dal sistema MHC. Le resine sulle foglie dell'edera velenosa
reagiscono con le proteine della pelle. Le cellule avvelenate tagliano
le proteine modificate e ne espongono i frammenti usando le molecole
MHC. L'eruzione cutanea e il prurito si scatenano quando il sistema
immunitario attacca queste cellule avvelenate della pelle.
Anche più grave è la reazione di rigetto provocata
dal MHC in seguito ai trapianti di pelle e di organo. E' questo
che ha dato il nome alla proteina: il termine istocompatibilità
si riferisce alla difficoltà di trovare tessuti compatibili tra
donatore e paziente che consentano di realizzare un trapianto. Ogni
persona ha un proprio insieme di molecole MHC. Ce ne sono un centinaio
di tipi diversi, ma ogni persona ne ha solamente quattro tipi (due da
ogni genitore). Se si trapianta un pezzo di pelle che ha un insieme
diverso di tipi MHC, questi inducono il sistema immunitario a distruggere
le cellule. La soluzione del problema sta nel trovare un donatore compatibile,
per esempio un parente, che abbia un insieme simile di molecole MHC.
Collegamento col cancro
Ci sono sempre più prove che dimostrano che
il sistema MHC è importante anche nella lotta del nostro corpo
contro il cancro. Le cellule cancerose, come quelle normali, espongono
frammenti delle loro proteine sulla superficie. Quindi, se qualcuna
di queste proteine contiene mutazioni cancerose riconoscibili, questo
costituisce un segnale per il sistema immunitario che qualcosa non va
e lo induce a distruggere le cellule.
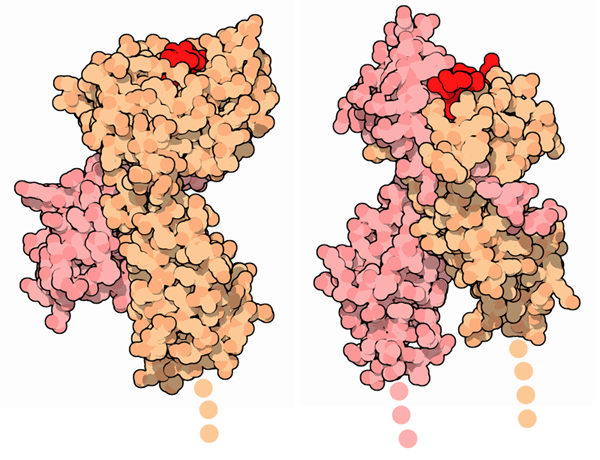 Tipi
e terminologia Tipi
e terminologia
Nel nostro corpo ci sono due tipi principali di
MHC. L'MHC di classe I (mostrato qui a fianco sulla sinistra,
file PDB 1hsa) si trova sulla superficie
delle cellule nucleate, dove ci protegge dalle infezioni virali.
L'MHC di classe II (mostrato qui a fianco sulla destra, file
PDB 1dlh) si trova nelle cellule specializzate
che presentano un antigene e hanno il compito di raccogliere proteine
in giro per il corpo ed attivare il sistema immunitario quando trovano
un peptide strano da esporre.
L'MHC di classe II, come l'MHC di classe I, si trova legato alla superficie
della cellula e possiede una tasca per legare ed esporre piccoli peptidi,
ma è diverso in alcuni dettagli.
Nell'MHC di classe II entrambe le catene hanno porzioni che attraversano
la membrana ed inoltre il sito di legame si trova in un incavo
tra le due catene.
Come accade spesso per le cose scientifiche, c'è anche una precisa
terminologia da conoscere: le molecole MHC umane di classe II vengono
spesso chiamate HLA, da human leucocyte antigens, antigeni leucocitari
umani.
. . . . .. . . . . . . . .. .
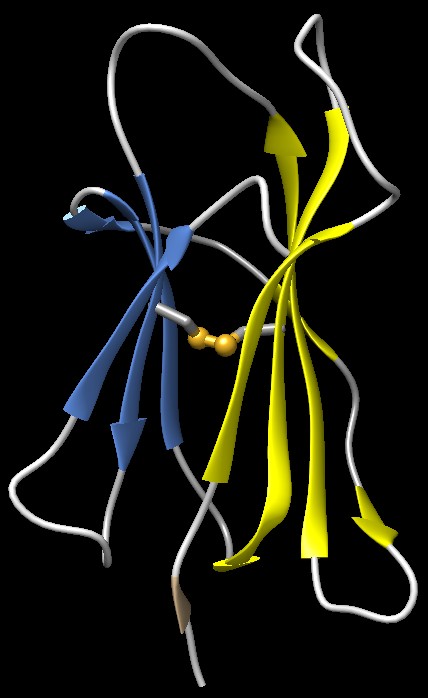 Una
famiglia di avvolgimenti Una
famiglia di avvolgimenti
Molte proteine del sistema immunitario possiedono
al loro interno un dominio a forma di sandwich ripetuto più volte
con lo stesso tipo di avvolgimento, composto da due strati sovrapposti
di strutture beta a foglietto pieghettato (nastri nella figura qui a
lato) (file PDB 2hla)
tenuti insieme da un ponte disolfuro (sfere gialle) tra due
amminoacidi di cisteina posti nel centro. Questa struttura caratteristica
si presenta in modo ricorrente in molte proteine del sistema immunitario.
Tre esempi sono mostrati qui sopra:
sulla sinistra, il recettore
di un linfocita T (mdm 3/2005) (file PDB 1tcr)
che ha quattro di questi domini;
al centro si può vedere un anticorpo (file PDB 1igt)
con 12 di questi domini;
sulla destra c'è il MHC (file PDB 2hla)
con due di questi domini.
La somiglianza tra le sequenze degli amminoacidi che formano queste
porzioni proteiche compatte indica che molte proteine del sistema immunitario
si sono evolute a partire da una stessa proteina capostipite.
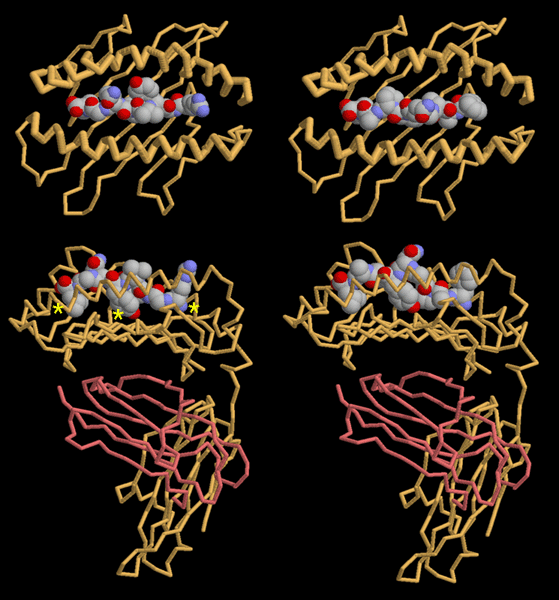 Esplorando
la struttura Esplorando
la struttura
Il sistema MHC nel suo complesso pone un problema:
ogni cellula produce migliaia di peptidi diversi da esporre, ma costruisce
solo pochi tipi di MHC. La soluzione a questo enigma è venuta
osservando le strutture di MHC con peptidi diversi.
Le due strutture mostrate qui a lato (file PDB 2vaa
sulla sinistra e file PDB 2vab sulla destra
visti da sopra e di fianco) contengono peptidi di due virus diversi
legati allo stesso MHC.
Guardando queste strutture, si può vedere che il peptide, di
nove amminoacidi, è tenuto in una conformazione distesa in un
incavo tra due lunghe alfa eliche, come è mostrato nelle due
immagini superiori (nella vista da sopra).
La proteina MHC afferra il peptide per le due estremità e per
una tirosina nel centro, come indicato dagli asterischi gialli (nella
vista di lato). Si noti che queste tre posizioni sono simili nelle due
strutture. Il peptide è ancorato al MHC in questi punti, ma gli
altri amminoacidi sono rivolti all'esterno, lontano dalla proteina,
per essere riconosciuti dai linfociti T.
Il mese prossimo, prenderemo in esame i recettori
dei linfociti T (mdm 3-2005) per vedere come il sistema immunitario
riconosce queste porzioni esposte dei peptidi.
 Bibliografia Bibliografia
S. Sell (2001) Immunology, Immunopathology and Immunity. ASM
Press, Washington, D. C.
K. Natarajan, H. Li, R. A. Mariuzza and D. H. Margulies (1999)
MHC Class I Molecules, Structure and Function. Reviews in Immunogenetics
1, 32-46.
I. A. York and K. L. Rock (1996) Antigen Processing and Presentation
by the Class I Major Histocompatibility Complex. Annual Review of Immunology
14, 369-396.
M. Matsumura, D. H. Fremont, P. A. Peterson and I. A. Wilson
(1992) Emerging Principles for the Recognition of Peptide Antigens by
MHC Class I Molecules. Science 257, 927-934.
|
|
|
 Introduzione
Introduzione
 Tipi
e terminologia
Tipi
e terminologia 
 Una
famiglia di avvolgimenti
Una
famiglia di avvolgimenti  Esplorando
la struttura
Esplorando
la struttura