|
|
Glutatione Transferasi |
|||||
|
Molecola del Mese di Agosto 2017 Glutatione transferasi marca le molecole tossiche rendendole facili da riconoscere ed eliminare. 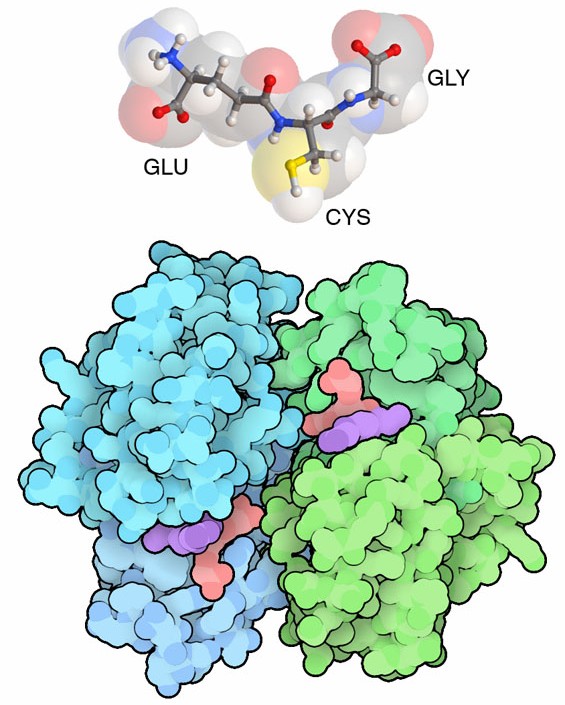 Introduzione IntroduzioneLe cellule contengono una massa disordinata di piccole molecole. Talvolta in questa miscela si introducono molecole pericolose e le cellule hanno la necessità di riconoscerle ed eliminarle. Una prima linea di difesa è costituita da enzimi come il citocromo p450 (mdm 10-2006) che modifica le catene carboniose delle tossine per renderle più solubili in acqua. Una seconda linea di difesa è costituita dall'enzima glutatione tranferasi che lega una maniglia chimica alle molecole indesiderate per consentire al meccanismo di pulizia cellulare di espellerle. Maniglia molecolare Il glutatione, mostrato qui a fianco in alto, è la maniglia molecolare utilizzata dalle nostre cellule e svolge al meglio il suo lavoro grazie a due caratteristiche fondamentali. La prima è che è ben riconoscibile e non può essere confuso con altre molecole della cellula. Il glutatione, infatti, anche se è composto di tre comuni amminoacidi, (acido glutammico, cisteina e glicina) non viene confuso con i normali peptidi perchè l'acido glutammico non è legato agli altri due amminoacidi nel modo usuale, con il carbossile principale, ma è legato con il suo secondo carbossile che si trova in fondo alla catena laterale e questo rende il glutatione una molecola del tutto anomala La seconda è che può essere inserito in modo semplice nelle molecole. Il glutatione contiene un atomo di zolfo in forma ridotta SH (giallo, nell'amminoacido cisteina) che viene facilmente attivato per diventare un potente nucleofilo S- e così si può legare ad una varietà di molecole diverse. Legate all'atomo di zolfo del glutatione, queste molecole diventano più solubili e possono essere eliminate dalla cellula e poi dall'organismo. Lavorare insieme Ci sono più di 20 enzimi glutatione transferasi diversi tra loro che lavorano insieme per esaminare continuamente il contenuto delle cellule ed eliminare le tossine. Quello mostrato qui sopra è uno dei più studiati, è chiamato hGSTP-1 (file PDB 3gss) e contiene due molecole di glutatione (arancione) legate a due tossine (viola). Questi 20 enzimi ci proteggono da diverse tossine come quelle prodotte da batteri e funghi, dalle molecole reattive che si formano durante la cottura del cibo o nel fumo di sigaretta e da una varietà di altri inquinanti ambientali. Per questo, ogni glutatione transferasi può riconoscere un gran numero di molecole pericolose e le lega al glutatione. Questo lavoro è così importante che in alcune cellule, come quelle del fegato, l'enzima glutatione transferasi costituisce fino al 10% del totale delle proteine. 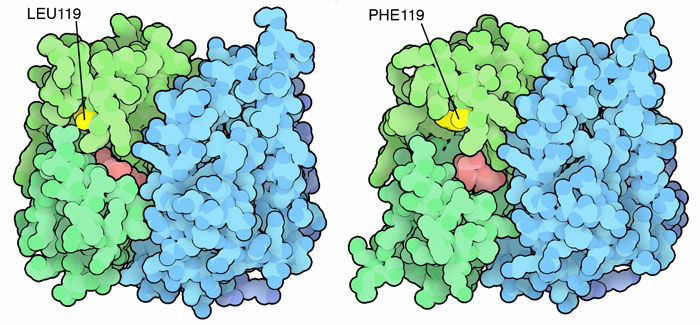 Zanzare
e DDT Zanzare
e DDTTalvolta il processo di detossificazione può finire in una specie di braccio di ferro tra tossine e molecole di difesa. Un esempio, osservato di recente, riguarda le zanzare della malaria. In Africa, per combattere le zanzare, è stato usato in modo esteso il DDT (un potente insetticida che si è rivelato tossico per l'ambiente), ma in seguito, nelle zone più trattate, sono comparse zanzare resistenti al DDT. Studiando queste zanzare, si è visto che la loro resistenza dipende da una mutazione genetica che produce un enzima glutatione transferasi mutante. E' sufficiente la mutazione di un solo amminoacido di leucina con uno più ingombrante di fenilalanina: questa piccola variazione causa un ripiegamento della proteina leggermente diverso che crea un sito attivo più grande che riesce a catturare la grossa molecola del DDT per legarla al glutatione . Nella figura qui sopra si possono vedere i due enzimi, quello naturale a sinistra e quello mutante a destra, (file PDB 3zml e 3zmk). L'amminoacido oggetto della mutazione è evidenziato in giallo, a sinistra vi è la leucina 119 (amminoacido originale) mentre a destra si vede la fenilalanina 119 nell'enzima mutante. Nella molecola di destra, si vede che il sito attivo è più grande e, sul fondo, si vede il glutatione (rosa). Esplorando la struttura L'enzima glutatione transferasi ha un ruolo centrale sia nell'eliminazione di tossine che di farmaci. Nelle immagini seguenti potete vedere il sito attivo dell'enzima glutatione transferasi in quattro situazioni diverse. Nella prima immagine si vede il sito attivo che contiene solo il glutatione (rosa). Nella seconda immagine qui sotto a destra (file PDB 3pgt) si vede il glutatione (rosa) legato attraverso l'atomo di zolfo (giallo) ad una pericolosa molecola cancerogena, il benzopirene (grigio e rosso) in forma parzialmente ossidata per opera del citocromo p450. 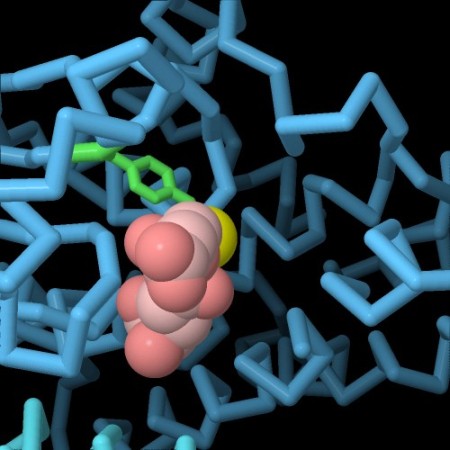 . . . .
. . . . 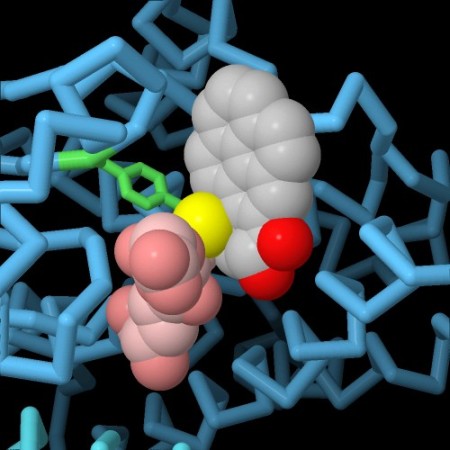
Nella terza immagine qui sotto a sinistra (file PDB 3csh) il sito attivo dell'enzima contiene il glutatione (rosa) legato con il suo atomo di zolfo (giallo) ad un comune farmaco antitumorale per la leucemia, clorambucil (grigio, rosso e verde). In questo modo l'enzima elimina il farmaco dalle cellule e ne diminuisce l'efficacia. Se però il farmaco viene somministrato assieme ad un inibitore dell'enzima glutatione transferasi, può agire più a lungo nel corpo. Nella quarta immagine qui sotto a destra (file PDB 3gss) si vede questo inibitore, acido etacrinico (grigio, rosso e verde), legato nel sito attivo accanto al glutatione (rosa). L'inibitore occupa il sito attivo dell'enzima e gli impedisce di legare il farmaco antitumorale. 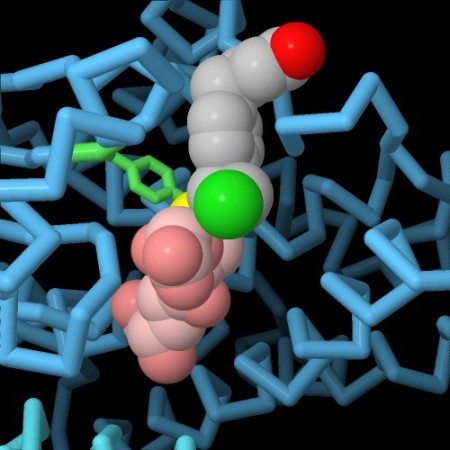 . . . .
. . . . 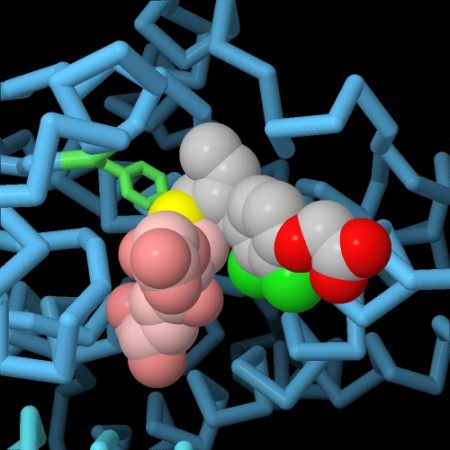 In tutte e quattro le immagini è stata evidenziato un amminoacido indispensabile per realizzare la reazione enzimatica, la tirosina (verde chiaro) che si trova vicino all'atomo di zolfo che deve reagire. Spunti per ulteriori esplorazioni Negli archivi PDB sono disponibili molte strutture di diversi enzimi glutatione trassferasi. Fate una ricerca per “glutathione transferase” per esaminarli. Questi enzimi, tipicamente, hanno due domini: uno che lega il glutatione e uno che interagisce con la molecola bersaglio. Osservandone la struttura, provate ad esaminarla come "cartoon" per mettere in evidenza i due domini. 3zmk, 3zml: JM Riveron, C Yunta, SS Ibrahim, R Djouaka, H Irving, BD Menze, HM Ismail, J Hemingway, H Ranson, A Albert & CS Wondji (2014) A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology 15, R27. PG Board, D Menon (2013) Glutathione transferases, regulators of cellular metabolism and physiology. Biochimica et Biophysica Acta 1830, 3267-3288. B Wu, D Dong (2012) Human cytosolic glutathione transferases: structure, function, and drug discovery. Trends in Pharmacological Sciences 33, 656-668. A Oakley (2011) Glutathione transferases: a structural perspective. Drug Metabolism Reviews 43, 138-151. 3csh: LJ Parker, S Ciccone, LC Italiano, A Primavera, AJ Oakley, CJ Morton, NC Hancock, M Lo Bello & MW Parker (2008) The anti-cancer drug chlorambucil as a substrate for the human polymorphic enzyme glutathione transferase P1-1: kinetic properties and crystallographic characterization of allelic variants. Journal of Molecular Biology 380, 131-144. JD Hayes, JU Flanagan & IR Jowsey (2005) Glutathione transferases. Annual Review of Pharmacology and Toxicology 45, 51-88. 3pgt: X Ji, J Blaszczyk, B Xiao, R O’Donnell, X Hu, C Herzog, SV Singh & P Zimniak (1999) Structure and function of residue 104 and water molecules in the xenobiotic substrate-binding site in human glutathione S-transferase P1-1. Biochemistry 38, 10231-10238. 3gss: AJ Oakley, J Rossjohn, M Lo Bello, AM Caccuri, G Federici & MW Parker (1997) The three-dimensional structure of the human Pi class glutathione transferase P1-1 in complex with the inhibitor ethacrynic acid and its glutathione conjugate. Biochemistry 36, 576-585
|
||||||
|
|
||||||
