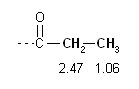|
 Problema
precedente Problema
precedente
 Problema successivo
Problema successivo
 Problema 14
Problema 14
 Tabella
A spostamenti HNMR Tabella
A spostamenti HNMR
 Tabella B calcolo spostamenti
Tabella B calcolo spostamenti
 Spettroscopia NMR
Spettroscopia NMR
 PianetaChimica home
PianetaChimica home
|
|
Dall'analisi della formula bruta C7H14O
osserviamo che,
se la molecola fosse satura, dovrebbe avere (2n+2) idrogeni
cioè 7+7+2 = 16 idrogeni. Dato che ne ha 14, mancano 2 idrogeni,
una coppia, quindi la molecola ha una insaturazione.
Lo spettro IR mostra un picco intenso a circa 1700 cm-1
che indica la presenza di un carbonile.
L'insaturazione è quindi dovuta al carbonile e la molecola è
un chetone senza altri doppi legami.
Lo spettro NMR presenta tre picchi con le seguenti caratteristiche:
|
spostamento
chimico
|
area
|
molteplicità
|
|
2.47
|
2
|
4 (q)
|
|
1.20
|
9
|
1 (s)
|
|
1.06
|
3
|
3 (t)
|

Cominciamo l'analisi
dal lato sinistro dello spettro. Il primo segnale che troviamo è
il quartetto di area 2 a 2.47 ppm, è dovuto ad un CH2
legato al carbonile che, infatti, dovrebbe assorbire (tabella B)
a:
1.0 CO + 1.3 CH2
= 2.3 ppm.
Dato il che il CH2
è un quartetto, è vicino a 3 idrogeni, quindi è
legato al CH3
tripletto a 1.06 ppm. Questo, essendo tripletto, è vicino
a due idrogeni, quelli del CH2
in esame a 2.47 ppm. Insieme costituiscono un gruppo etile (q,A2 + t,A3).
L'assorbimento di questi due segnali è in accordo con i valori
attesi:
(CH2 a 2.47 ppm):
1.0 CO + 1.3 CH2
= 2.3 ppm
(CH3 a 1.06 ppm):
0.9 CH3 + 0.2 beta
CO = 1.1 ppm
La struttura della molecola rivelata finora è
quindi:
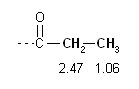
Il segnale successivo, nello spettro, è
il singoletto di area 9 a 1.20 ppm, è dovuto a tre CH3
che, essendo singoletti, sono legati ad un carbonio senza idrogeni e
quindi formano un gruppo terzbutile che deve essere legato dall'altro
lato del carbonile.
La molecola è così completamente determinata:
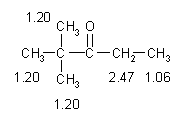
Si tratta di 2-2-dimetil-3-pentanone
|