|
Molecola del mese di giugno 2003
Una piccola proteina fluorescente di medusa
ha rivoluzionato la biologia cellulare
 Introduzione Introduzione
La proteina fluorescente verde, illustrata qui a lato (file PDB 1gfl)
si trova in una medusa che vive nelle acque fredde del nord Pacifico.
La medusa contiene una proteina bioluminescente, equorina, che
emette luce blu. La proteina fluorescente verde converte questa luce in
luce verde che è quella che davvero vediamo quando la medusa si
illumina. Una soluzione di proteina GFP purificata appare gialla alla
normale luce da interni ad incandescenza, ma quando viene osservata in
esterni alla luce del sole, questa soluzione emette un brillante colore
verde. La proteina assorbe la luce ultravioletta dalla luce del sole,
e poi la emette come luce fluorescente verde di minore energia.
Inseguire la luce verde
Anche se a prima vista può sembrare poco
importante, la proteina GFP è molto utile alla ricerca scientifica,
perché permette di osservare direttamente il funzionamento interno
delle cellule viventi. È facile scoprire dove si trova in ogni
momento la proteina GFP: basta illuminare con luce ultravioletta,
ed ogni proteina GFP emetterà una luce fluorescente verde
brillante. Quindi basta legare la proteina GFP ad un oggetto altrimenti
invisibile e questo diventerà osservabile. Per esempio, possiamo
legarla ad un virus. Poi, quando il virus si diffonde nell'ospite, possiamo
seguire questa diffusione osservando il bagliore verde. Oppure, possiamo
legarla ad un'altra proteina, e guardare con un microscopio come si
muove all'interno della cellula. Recentemente gli scienziati hanno sviluppato
un nuovo strumento di questo tipo, gli aptameri
di RNA fluorescenti (mdm 1-2019), che permette di osservare
nello stesso modo l'RNA.
Costruita già pronta
La proteina GFP è una proteina fluorescente costruita già
pronta per funzionare, quindi è particolarmente facile da utilizzare.
La maggior parte delle proteine che interagiscono con la luce utilizzano
molecole esotiche per catturare e rilasciare fotoni. Per esempio, la
rodopsina
(mdm 3/2012) nei nostri occhi usa il retinolo per sentire la luce. Questi
"cromofori" devono essere costruiti appositamente per svolgere
questo compito e poi incorporati con cura nelle proteine. La proteina
GFP, invece, ha dentro di sè tutto l'apparato per manipolare
la luce, costituito utilizzando solo amminoacidi. Ha una sequenza speciale
di tre amminoacidi: treonina-tirosina-glicina (qualche volta,
la treonina è sostituita da serina, un amminoacido simile).
Quando la catena proteica si avvolge, questo piccolo segmento si trova
sepolto in profondità all'interno della proteina. A questo punto
avvengono alcune trasformazioni chimiche: la glicina forma un legame
chimico con la treonina, formando un nuovo anello chiuso che poi spontaneamente
si disidrata. Infine, nel corso di circa un'ora, l'ossigeno dall'ambiente
circostante attacca un legame nella tirosina, formando un nuovo doppio
legame e creando il cromoforo fluorescente. Dato che la proteina GFP
costruisce al suo interno il proprio cromoforo, è perfetta per
l'ingegneria genetica. Non bisogna preoccuparsi di manipolare strani
cromofori. Basta semplicemente modificare la cellula introducendo le
istruzioni genetiche per costruire la proteina GFP, e la GFP si avvolgerà
da sola e comincerà a brillare.
Ingegnerizzare la proteina GFP
Gli usi della proteina GFP si stanno moltiplicando anche nel mondo dell'arte
e del commercio. L'artista Eduardo Kac ha creato un coniglio verde fluorescente
ingegnerizzando la proteina GFP nelle sue cellule. Alcuni ricercatori
stanno esplorando la proteina GFP per creare piante e pesci fluorescenti.
La proteina GFP è stata aggiunta a ratti, topi, rane, mosche,
vermi, e ad altre innumerevoli forme viventi . Naturalmente queste piante
e animali ingegnerizzati sono ancora oggetto di controversie, e stanno
stimolando un importante dialogo sulla sicurezza e la moralità
dell'ingegneria genetica.
 Migliorare
la proteina GFP Migliorare
la proteina GFP
La proteina GFP è molto utile per studiare le cellule viventi,
e i ricercatori stanno rendendola ancora più utile. Stanno inserendo
con l'ingegneria genetica molecole di proteina GFP che emettono per
fluorescenza colori diversi. I ricercatori ora possono fare proteine
fluorescenti blu, gialle e di altri colori. Il metodo per riuscirci
è introdurre piccole mutazioni che alterano la stabilità
del cromoforo. Migliaia di varianti diverse sono già stata sperimentate,
e nel PDB se ne possono trovare molte che si sono dimostrate funzionanti.
I ricercatori stanno anche usando la proteina GFP per creare dei biosensori:
macchine molecolari che sentono i livelli di ioni o il pH, e poi trasmettono
i risultati diventando fluorescenti in modi caratteristici. La molecola
mostrata qui a lato (file PDB 1kys) è
una proteina fluorescente blu che è stata modificata per
sentire il livello di ioni zinco. Quando lo zinco (mostrati in
rosso) si lega al cromoforo modificato (blu) la proteina diventa due
volte più fluorescente, creando un segnale visibile che può
essere facilmente osservato.
Esplorando la struttura
Nella figura qui sotto (file PDB 1ema)
potete osservare la proteina GFP con il suo cromoforo. La catena è
stata colorata ad arcobaleno, con colori che vanno dal blu (nella parte
N-terminale) al rosso (nella parte C-terminale). La struttura della
proteina è notevole, ha una forma a barile generata da una disposizione
ordinata di tratti beta pieghe che salgono e scendono tutto intorno.
All'interno del barile entra il tratto di catena azzurro che contiene
il cromoforo, mostrato in verde, generato dalla fusione di tre amminoacidi
della catena: glicina, tirosina, treonina. Il cromoforo si trova proprio
nel mezzo del barile, totalmente schermato dall'ambiente circostante.
Questa schermatura è essenziale per la fluorescenza. Le molecole
d'acqua accalcandosi attorno al cromoforo gli ruberebbero l'energia
dopo che questo ha assorbito un fotone. All'interno della proteina,
il cromoforo è protetto, e può rilasciare energia emettendo
un fotone di luce con energia leggermente inferiore a quella assorbita.
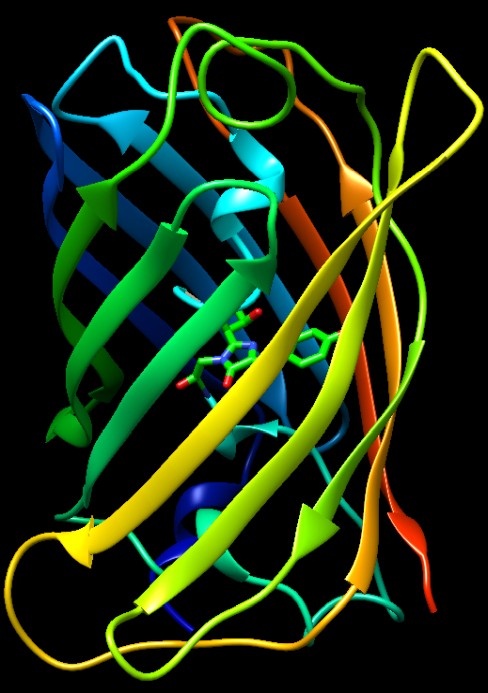
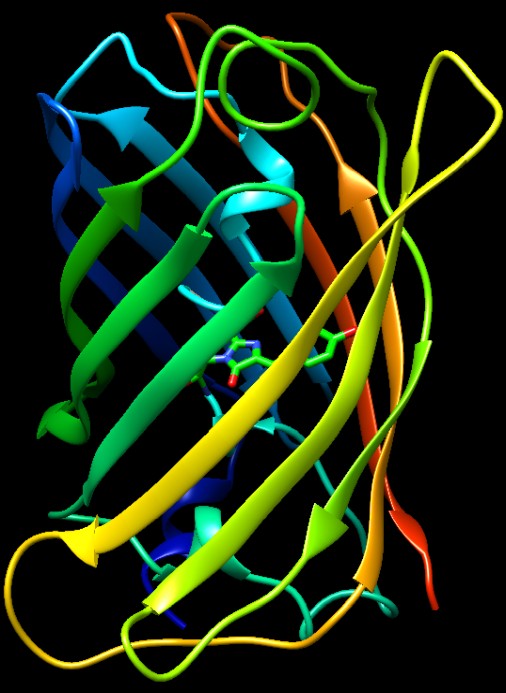
Le due immagini affiancate qui sopra forniscono una visione 3D della
proteina se osservate a sguardo incrociato con la seguente procedura.
Mettete le mani a coppa 15 cm davanti ai vostri occhi e lasciate tra
i palmi un foro attraverso cui guardare le immagini.
Mantenendo ferma la testa, trovate la posizione delle mani con la quale,
guardando solo con l'occhio sinistro, vedete l'immagine di destra e
guardando solo col destro, vedete l'immagine di sinistra.
Guardando con entrambi gli occhi, nel foro tra le mani vedrete l'immagine
3D della molecola.
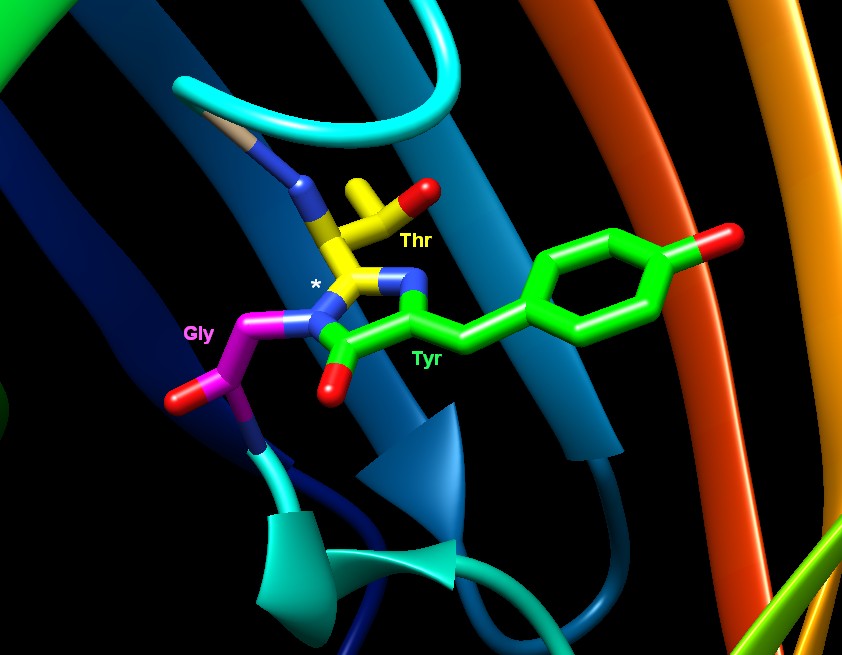
Qui sotto è mostrato il cromoforo in primo piano. Si forma spontaneamente
a partire da tre amminoacidi nella catena proteica: treonina (Thr),
tirosina (Tyr) e glicina (Gly). Notate che glicina e treonina hanno
formato un nuovo legame, indicato dall'asterisco, creando un insolito
anello a cinque atomi.
. . . . . . . . . 
 Bibliografia Bibliografia
Roger Y. Tsien (1998): The Green Fluorescent
Protein. Annual Review of Biochemistry 67, pp. 509-544.
|
|
|
 Introduzione
Introduzione
 Migliorare
la proteina GFP
Migliorare
la proteina GFP

