|
Molecola del mese di agosto 2004
Le caspasi tagliano le proteine durante il processo di apoptosi,
la morte cellulare programmata
 Introduzione Introduzione
Miliardi di cellule del nostro corpo moriranno entro
la prossima ora. Questo è del tutto normale perchè il
corpo si rinnova continuamente eliminando le cellule vecchie o danneggiate
e sostituendole con cellule nuove e sane. Questa operazione, però,
deve essere eseguita con grande prudenza. Se le cellule vengono danneggiate,
come quando ci tagliamo, possono gonfiarsi e scoppiare, contaminando
l'area circostante. Il nostro corpo risponde duramente a questo tipo
di morte cellulare, provocando nella zona un'infiammazione, cioè
facendo giungere cellule del sangue per pulire ogni residuo. Per evitare
questi problemi, le cellule vecchie o danneggiate vengono eliminate
con una tecnica di morte programmata pulita e rapida. Quando
giunge il segnale, la cellula comincia a smontare le sue strutture interne
e si suddivide in piccoli frammenti ordinati che possono essere consumati
rapidamente dalle cellule vicine. Questo processo di morte controllata
e antisettica viene chiamato apoptosi.
Quali cellule devono morire?
L'apoptosi interviene in molti casi. Durante lo
sviluppo embrionale, gli organi vengono plasmati costruendo strutture
più grandi del necessario e poi eliminando le cellule in eccesso.
Durante lo sviluppo del sistema nervoso, per esempio, metà
dei neuroni vengono fatti morire per lasciare una rete neurale efficiente.
Quando un girino perde la coda, è l'apoptosi che sta agendo
in modo massiccio. Anche negli adulti, l'apoptosi continua ad agire
quando le cellule invecchiate muoiono e vengono sostituite da
cellule nuove, soprattutto negli organi con un grande ricambio cellulare
come il midollo osseo e l'intestino. L'apoptosi, inoltre, ci protegge
dalle cellule danneggiate dalle radiazioni o infettate dai virus.
Quando vengono scoperte, queste cellule pericolose sono idotte subito
al suicidio. L'apoptosi è anche una delle nostre difese più
importanti contro il cancro, ma le cellule cancerose maligne
spesso hanno delle mutazioni che disattivano il loro meccanismo di apoptosi.
Carnefice
Le Caspasi sono i carnefici dell'apoptosi. Sono
enzimi proteolitici che, uando sono attivati da speciali molecole
guardiane, gli apoptosomi, tagliano proteine strategiche nella cellula.
Il nome
C-ASP-ASI (Cisteina acido ASPartico proteASI) si riferisce a
due proprietà di questi enzimi.
1) Sono proteasi alla cisteina che usano l'atomo di zolfo di
una cisteina per tagliare le proteine.
2) Tagliano le proteine in corrispondenza di amminoacidi di acido
aspartico. Non tagliano in modo casuale, ma sono progettate per
fare esattamente i tagli necessari per smontare le proteine in modo
ordinato.
Caspasi con ruoli diversi
Sono state scoperte almeno una dozzina di caspasi
nelle cellule umane, ognuna con un compito lievemente diverso. Le strutture
di molte di queste sono disponibili nel PDB. Tre sono mostrate qui a
fianco.
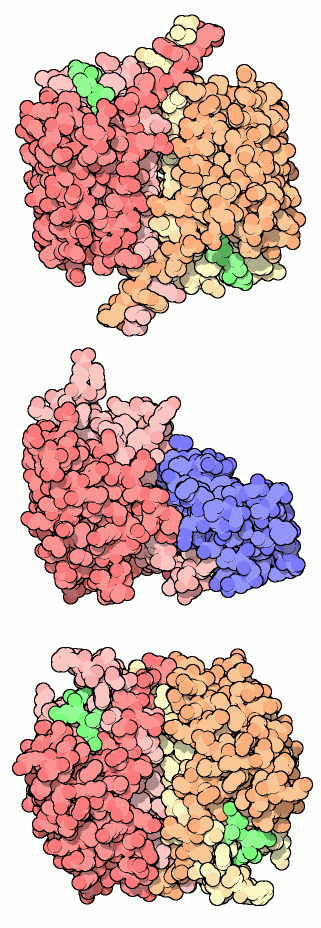
La caspasi-1, la prima ad essere scoperta, è mostrata
qui a destra in alto (file PDB 1ice) ed
è anche nota come enzima di conversione della interleuchina-1
beta. Non è coinvolta direttamente nell'apoptosi, ma elabora
una molecola di segnalazione cellulare nei globuli bianchi del sangue.
Come nelle altre caspasi, la forma attiva è composta da due subunità,
ognuna delle quali è formata da due catene. La struttura contiene
anche dei piccoli inibitori (verdi) nei due siti attivi.
La caspasi-9 è mostrata qui a fianco al centro (file PDB
1nw9) legata ad una proteina inibitrice
(blu). L'inibitore la mantiene in una forma inattiva e quando viene
rilasciato, questa caspasi può legarsi con un'altra e formare
un complesso attivo più grande. La caspasi-9 è una iniziatrice
del processo di apoptosi. Quando riceve il segnale per cominciare il
processo, viene attivata e fa un taglio in una caspasi effettrice.
La caspasi-3, mostrata qui a fianco in basso (file PDB 1pau),
è una effettrice, insieme con altre caspasi effettrici,
svolge il pesante lavoro di smontare le proteine della cellula.
 Aiutanti
per l'apoptosi Aiutanti
per l'apoptosi
Le Caspasi sono progettate per tagliare le proteine
in piccoli frammenti, ma la cellula deve rompere anche altre molecole
come gli acidi nucleici e quindi ha bisogno di un ulteriore aiuto. Per
questo le cellule possiedono un certo numero di proteine attivate dalle
caspasi. Quella mostrata qui a fianco (file PDB 1v0d
e 1c9f) è la deossiribonucleasi
(DNAasi) attivata dalla caspasi. Durante l'apoptosi, le caspasi tagliano
una proteina inibitrice che si lega ai due grandi domini sotto la molecola,
generando la forma attiva. Il DNA scivola nel grande incavo posto sopra
la molecola e gli amminoacidi del sito attivo (evidenziati in verde)
lo tagliano in piccoli frammenti.
Esplorando la struttura
Come potete immaginare, le caspasi sono enzimi pericolosi
per le cellule, così vengono creati sotto forma di proenzimi
inattivi.
La struttura qui sotto sulla sinistra è la procaspasi-7
(file PDB 1k88) un proenzima inattivo.
I tre amminoacidi chiave del sito attivo sono una cisteina reattiva
(Cys) e due arginine basiche (Arg) che riconoscono l'acido aspartico
(Asp) nella proteina che deve essere tagliata. Nella procaspasi, però,
questi tre amminoacidi chiave non sono riuniti in un sito attivo compatto.
Osservate, infatti che il tratto di catena giallo spinge la cisteina
in una posizione diversa rispetto a quella mostrata a destra.
La struttura qui sotto sulla destra (file PDB 1f1j)
mostra la forma attiva della caspasi-7. Questa si è formata
dopo che la procaspasi-7 ha subito un taglio strategico nella catena
proteica in un tratto (non visibile) compreso tra i due segmenti gialli.
Questo ha permesso ai tratti di catena gialli di rilassarsi e così
il sito attivo ha potuto assumere la conformazione corretta.
Nel sito attivo della caspasi-7 è presente anche un piccolo frammento
di una catena proteica (rosa) troncato in corrispondenza di un acido
aspartico che è rimasto legato con legame tioestere (zolfo giallo)
alla cisteina (azzurra) che ha tagliato la catena.


La struttura PDB 1f1j della caspasi-7
coglie l'enzima nel mezzo della sua reazione. Le arginine basiche (Arg,
azzurre) hanno circondato l'acido aspartico (Asp) della catena bersaglio.
La cisteina (Cys) ha tagliato la catena proteica bersaglio e si è
legata all'acido aspartico formando un tioestere. Nella figura qui sotto
è mostrato in dettaglio il sito attivo durante la reazione.
. . . . . . . . . . 
 Bibliografia Bibliografia
S. W. Hetts (1998) To die or not to die:
an overview of apoptosis and its role in disease. Journal of the
American Medical Society 279, 300-307.
D. W. Nicholson and N. A. Thornberry (1997) Caspases: killer
proteases. Trends in Biochemical Sciences 22, 299-306.
S. W. Fesik (2000) Insights into programmed cell death through
structural biology. Cell 103, 273-282.
Y. Shi (2002) Mechanisms of caspase activation and inhibition
during apotosis. Molecular Cell 9, 459-470.
|
|
|