|
|
Emoagglutinina |
|||||
|
Molecola del Mese di Aprile 2006 Il virus dell'influenza si lega alle cellule e le infetta usando l'emoagglutinina 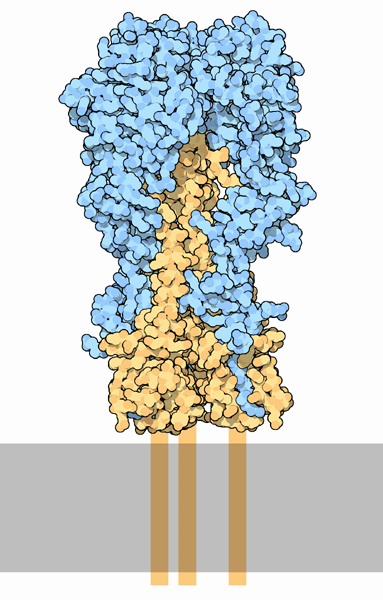 Introduzione
IntroduzioneIl virus dell'influenza è un nemico pericoloso. Normalmente il sistema immunitario combatte le infezioni virali uccidendo i virus e provocando per alcuni giorni i fastidiosi sintomi dell'influenza. Ogni anno i vaccini antiinfluenzali attivano il nostro sistema immunitario per metterlo in grado di combattere i più comuni virus influenzali. Ogni ventina d'anni, però, compare un nuovo ceppo influenzale che si rivela molto più virulento e che quindi si diffonde con grande rapidità. Questo è accaduto, per esempio, alla fine della prima guerra mondiale provocando una pandemia (nota come Spagnola) che ha ucciso più di 20 milioni di persone, più del doppio delle persone che erano morte in guerra. Agganciare il bersaglio ed attaccare L'emoagglutinina è uno dei fattori che rendono il virus dell'influenza così efficiente. E' una proteina a forma di punta che si estende fuori dalla superficie del virus. Nella forma attiva mostrata qui a fianco (file PDB 1ruz), l'emoagglutinina è composta da due diversi tipi di catene (blu e beige). Le catene blu costituiscono il meccanismo di aggancio del bersaglio: cercano particolari catene di zuccheri sulla superficie delle cellule. Quando le trovano, l'emoagglutinina vi si lega, agganciando così il virus alla cellula. Le catene beige, che sono ancorate alla superficie del virus (grigio), attaccano la membrana della cellula agganciata, come è mostrato qui sotto. Il nome emoagglutinina si riferisce all'abilità del virus dell'influenza di far agglutinare i globuli rossi: il virus è coperto di molte molecole di emoagglutinina che possono legare molti globuli rossi creando un grumo così grande da essere visibile. Sottotipi nascosti La specificità e quindi la pericolosità di ogni ceppo di virus influenzale dipende dal tipo particolare di emoagglutinine che possiede. Si conoscono più di una dozzina di sottotipi di emoagglutinine. Tre di queste, chiamate H1, H2 e H3 (H è l'iniziale del nome inglese Hemagglutinin), attaccano l'uomo perchè sono in grado di riconoscere alcuni particolari zuccheri sulla superficie delle cellule del nostro tratto respiratorio, è per questo che l'infezione comincia lì quando prendiamo l'influenza. Altri sottotipi, come H5, attaccano glicoproteine presenti nel sistema digerente degli uccelli. La maggior parte di questi sottotipi non è pericolosa per l'uomo e non minaccia nemmeno la vita degli uccelli e quindi costituisce una specie di riserva nascosta di virus. Un pericolo potenziale, però, può venire dallo scambio di geni tra ceppi diversi. Il virus H5N1 dell'influenza aviaria che è venuto alla ribalta della cronaca in questo periodo, sta decimando la popolazione degli uccelli, ma non costituisce al momento un vero pericolo per l'uomo perchè non possiede la giusta emoagglutinina per attaccare le cellule umane. La sigla N1 si riferisce ad un sottotipo di una seconda proteina virale di superficie: la neuraminidasi (mdm 5-2009) che il virus usa per staccarsi dalla cellula infettata e propagare l'infezione. Esiste, però, la possibilità che il virus possa acquisire una emoagglutinina specifica per l'uomo e che quindi ci possa causare dei veri problemi. Questo potrebbe avvenire, per esempio, attraverso i maiali. Questi, infatti, sono suscettibili sia ai virus aviari che a quelli umani. Se uno stesso maiale venisse infettato contemporaneamente da entrambi i tipi di virus, questi potrebbero scambiarsi i geni durante l'infezione. In questo modo si potrebbe creare un nuovo virus con la virulenza dei virus aviari e in più con l'abilità di attaccare le cellule umane. Agente letale L'emoagglutinina mostrata qui sopra è stata ricavata dal virus responsabile della pandemia che ha ucciso milioni di persone nel 1918, l'influenza Spagnola. Il DNA che codifica per questa emoagglutinina è stato isolato da campioni conservati e l'emoagglutinina è stata sintetizzata in laboratorio in accordo con queste informazioni genetiche. Si sono ottenute due strutture cristalline, la forma attiva mostrata qui (file PDB 1ruz), e un precursore dell'emoagglutinina, non mostrato (file PDB 1rd8). La proteina è fissata alla membrana virale da un corto filamento proteico che non si può vedere nella struttura cristallina e che qui è rappresentato in modo schematico dai segmenti beige in basso. Emoagglutinina in azione  L'emoagglutinina
é una spietata macchina molecolare che aggancia e infetta le nostre
cellule. Questo processo si realizza in più passaggi. L'emoagglutinina
é una spietata macchina molecolare che aggancia e infetta le nostre
cellule. Questo processo si realizza in più passaggi. Nel primo, i tre siti di legame sulla cima della proteina si legano agli zuccheri di alcune glicoproteine della membrana cellulare mostrate in verde in alto a sinistra nella figura (file PDB 1hge). Nel secondo passaggio il virus entra nella cellula per endocitosi, cioè la cellula ospite forma un endosoma, un'invaginazione della membrana cellulare, nel quale cerca di digerire il virus creando un ambiente acido. Il virus però resiste a questo attacco, anzi l'ambiente acido gli serve per innescare il suo meccanismo di contrattacco alla cellula. Grazie all'ambiente acido, l'emoagglutinina si apre e si ripiega assumendo una struttura del tutto diversa. Le porzioni arancioni e rosse di solito sono ripiegate all'interno della proteina, ma in ambiente acido si portano all'esterno come mostrato nell'immagine centrale della figura qui sopra (file PDB 1htm, 1ibn, 2vir). La porzione rossa è chiamata peptide di fusione, ha una grande affinità per le membrane, così si inserisce nella membrana cellulare e vi aggancia saldamente il virus. Nel terzo passaggio, come si vede nella parte destra della figura (file PDB 1qu1), le porzioni gialle si avvolgono su quelle arancioni e questo fa contrarre la proteina e costringe le due membrane ad avvicinarsi fino quasi a toccasi una con l'altra. Infine la due membrane si fondono e l'RNA virale entra nella cellula cominciando il processo di infezione. Esplorando la struttura Gli anticorpi (mdm 9-2001) sono la nostra prima linea di difesa contro il virus dell'influenza. L'immagine qui sotto (file PDB 1qfu) mostra come un anticorpo attacca l'emoagglutinina bloccandola in modo che non possa più legarsi alla superficie delle cellule. La struttura comprende l'emoagglutinina (azzurra e beige) e tre copie del frammento Fab dell'anticorpo (magenta) che ingabbiano la testa dell'emoagglutinina. . . . . . 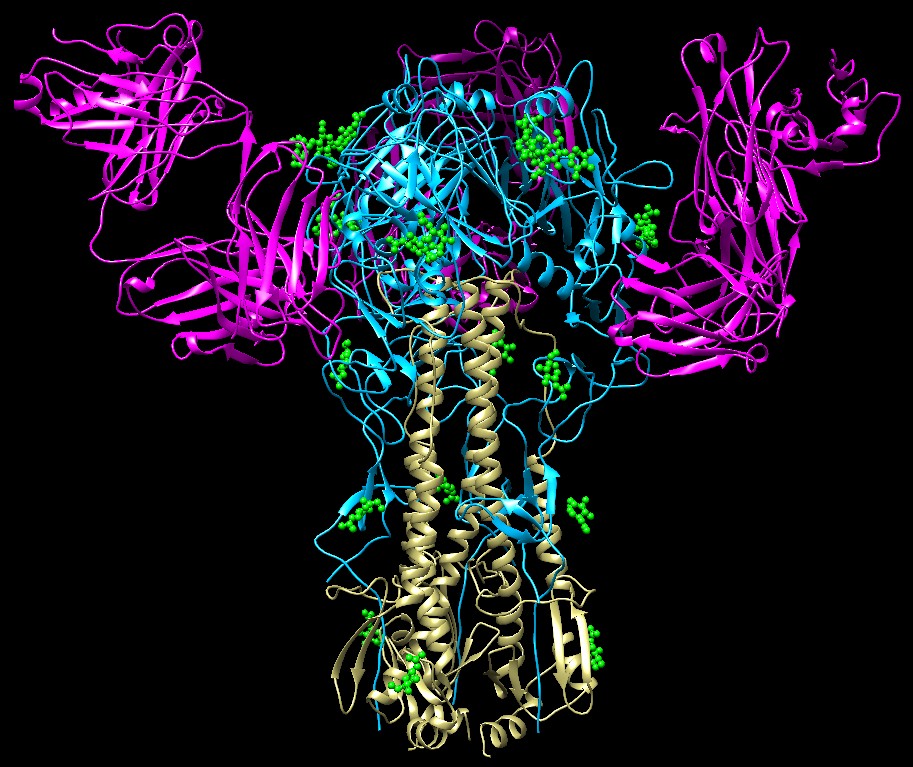 Naturalmente i virus hanno delle strategie per sfuggire all'attacco degli anticorpi e così ogni anno nascono nuovi ceppi virali in grado di infettarci. Una delle strategie usate dai virus consiste nel cambiare la disposizione dei carboidrati (verdi) sulla superficie dell'emoagglutinina. Se il virus aggiunge un nuovo carboidrato proprio nel punto dove si dovrebbe legare l'anticorpo, gli impedsce di legarsi e lo rende inefficace. JJ Skehel and DC Wiley (2000) Receptor binding and membrane fusion in virus entry: the influenza hemagglutinin. Annual Review of Biochemistry 69, 521-569. RG Webster and EJ Walker (2003) Influenza. American Scientist 91(March-April), 122- 129. TH Sollner (2004) Intracellular and viral membrane fusion: a uniting mechanism. Current Opinion in Cell Biology 16, 429-435.
|
||||||
|
|
||||||
