|
Molecola del Mese di marzo 2010
La glicoproteina P spinge fuori dalla cellula le molecole tossiche, ma
è anche responsabile della resistenza multifarmaco dei tumori
 Introduzione Introduzione
L'ambiente è pieno di sostanze tossiche che possono attaccare le
nostre cellule. Queste si difendono in molti modi. In alcuni casi usano
enzimi per trasformare le molecole dannose in modo da renderle innocue.
In altri casi sequestrano i composti pericolosi togliendoli di mezzo.
Infine le cellule possono costruire delle pompe specializzate per individuare
le molecole velenose ed espellerle all'esterno della membrana cellulare.
Fare piazza pulita
La glicoproteina P, mostrata qui dal file PDB 3g61,
è la più comune pompa molecolare che protegge le nostre
cellule dalle molecole tossiche. Si trova nella membrana cellulare
ed è continuamente alla ricerca di molecole estranee idrofobiche.
Quando ne trova una la intrappola in una tasca profonda all'interno
della proteina e poi cambia la propria conformazione. La nuova conformazione
ha un'apertura verso l'esterno della cellula e la molecola viene espulsa.
Questo processo funziona consumando una molecola di ATP per garantire
che tutto avvenga rapidamente.
Pompa efficiente
Naturalmente, per realizzare il proprio compito, la glicoproteina P
deve poter espellere molti tipi di molecole. I ricercatori hanno scoperto
che la glicoproteina P può pompare fuori dalla cellula centinaia
di molecole diverse con dimensioni che vanno da poche decine di
atomi fino a centinaia di atomi. La maggior parte di queste sono idrofobiche
e si trovano quindi sciolte nella membrana cellulare. Tra queste
ci sono molte molecole tossiche, ma anche farmaci importanti
come le ciclosporine e i farmaci antitumorali. Per questo
motivo, l'attività della glicoproteina P è sia benefica
che dannosa perchè da un lato ci protegge dalle tossine, ma dall'altro
riduce l'efficacia dei farmaci che assumiamo nelle terapie. .
Bloccare la pompa
Le cellule cancerose presenti nei tumori che hanno prodotto metastasi,
sono più difficili da trattare perchè sono diventate resistenti
a molti farmaci antitumorali. In alcuni casi queste cellule hanno acquistato
una resistenza multifarmaco sintetizzando una grande quantità
di glicoproteina P che espelle in continuazione i farmaci
antitumorali mandandoli fuori dalla cellula cancerosa. I ricercatori
stanno intensificando i loro sforzi per trovare un modo per bloccare
la glicoproteina P nelle cellule cancerose in modo da renderle ancora
sensibili ai trattamenti chemioterapici.
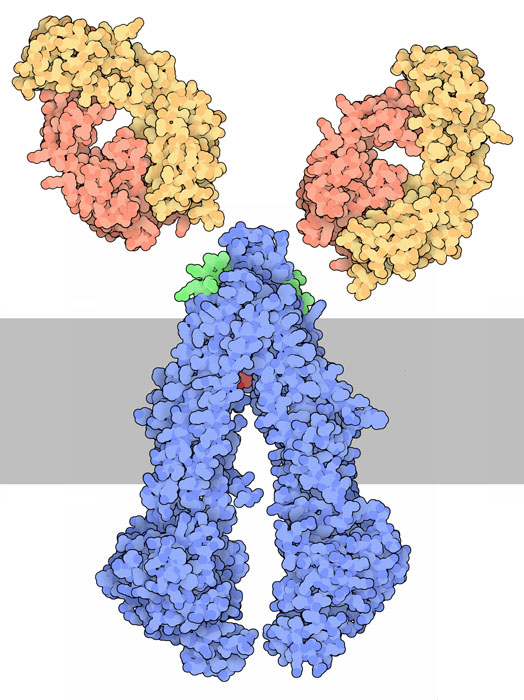
Una stategia consiste nell'usare anticorpi come quelli mostrati
qui a destra (file PDB 1bln in giallo
e arancione). Questi si legano ad una piccola regione della glicoproteina
P, mostrata in verde, e le impediscono i movimenti necessari all'azione
di pompaggio.
Un altro approccio consiste nel cercare farmaci che entrino nel sito
attivo della proteina e ne blocchino l'azione dall'interno.
 Esporando
la struttura Esporando
la struttura
La glicoproteina P è formata da una lunga
catena che si ripiega in due metà molto simili. Nelle figure
qui a lato, la prima metà della proteina è colorata in
blu, la seconda metà in verde. Un corto segmento di proteina
che lega le due metà non è visibile in questa struttura
cristallina (è troppo mobile) e quindi è mostrato con
una linea tratteggiata magenta.
Notate quanto sono simili le due metà e quanto sia estesa la
loro sovrapposizione. Si crede che la proteina si sia evoluta in seguito
ad una fortuita duplicazione del gene che la codificava e questo ha
prodotto una proteina più lunga formata da due metà quasi
identiche.
Qui a destra è mostrata la glicoproteina
P legata a due farmaci diversi (in rosso): file PDB 3g60
sulla sinistra e 3g61 sulla destra. Notate
che i due farmaci si legano in punti leggermente diversi all'interno
del grande sito attivo della proteina.
Nell'immagine qui sotto, realizzata con Chimera
(vedi Chimica al Computer),
si vede in dettaglio il farmaco contenuto nella glicoproteina
P (quella mostrata qui sopra a sinistra, file PDB 3g60).
Il farmaco è completamente circondato dalle catene ad alfa elica
della proteina. Per vederlo meglio, le alfa eliche azzurre più
vicine a noi sono state interrotte. Ognuno dei tre anelli a cinque atomi
del farmaco contiene un atomo di azoto (blu) e un atomo di selenio
(giallo).

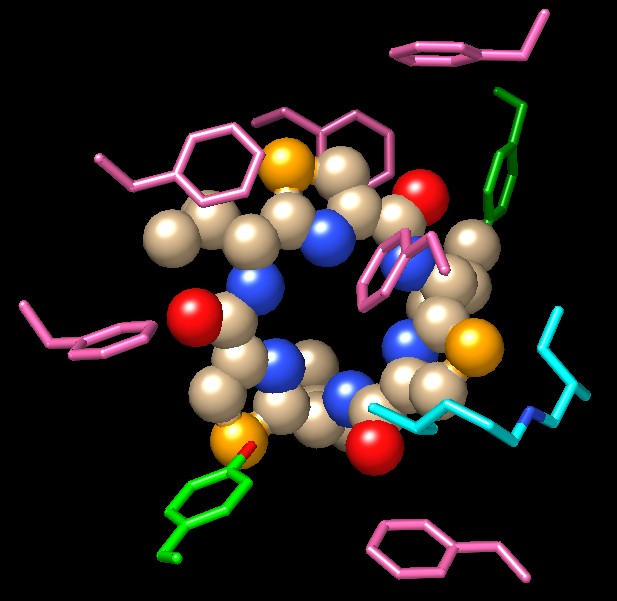
Qui a lato sono mostrati gli amminoacidi che si affacciano sulla tasca
della proteina che ospita il farmaco. Si notano molti amminoacidi apolari
tra i quali vi sono sei fenilalanine (rosa), due tirosine (verdi), una
leucina e una isoleucina (azzurre). Una tasca prevalentemente apolare
è in grado di legare farmaci apolari come quello in figura.
. . . . . . . . . . . . . . . . . . . . 
Spunti per ulteriori esplorazioni
1) I batteri costruiscono molti tipi diversi di
pompe per espellere molecole tossiche. Cercatene altri esempi negli
archivi PDB. Utilizzano lo stesso meccanismo a forbice?
2) Cercate altri esempi di probabile duplicazione di geni nel PDB
 Bibliografia
Bibliografia
S. V. Ambudkar, S. Dey, C. A. Hrycyna, M. Ramachandra, I. Pastan
and M. M. Gottesman (1999) Biochemical, cellular, and pharmacological
aspects of the multidrug transporter. Annual Review of Pharmacology
and Toxicology 39, 361-398.
G. Szakacs, J. K. Paterson, J. A. Ludwig, C. Booth-Genthe and
M. M. Gottesman (2006) Targeting multidrug resistance in cancer. Nature
Reviews Drug Discovery 5, 219-234.
M. Hennessy, J. P. Spiers (2007) A primer on the mechanics of
P-glycoprotein the multidrug transporter. Pharmacological Research
55, 1-15.
|
|
|
 Introduzione
Introduzione



