|
|
Inteine |
|||||
|
Molecola del Mese di Novembre 2010 Le inteine sono proteine ottenute ritagliando una porzione interna di una proteina più grande, i frammenti residui (exteine) sono poi ricongiunti 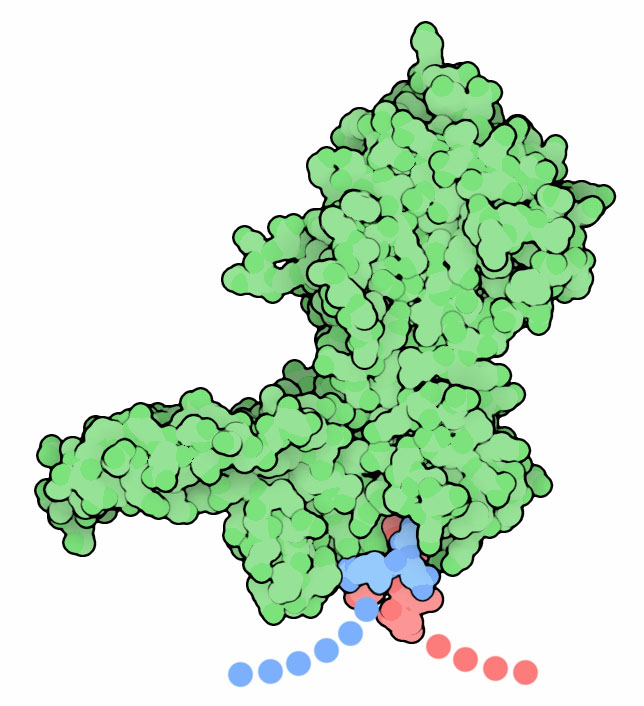 Introduzione IntroduzioneNella maggior parte dei casi i geni codificano per una singola proteina. Esistono casi particolari, però, nei quali questa limitazione può essere aggirata. I virus, per esempio, dato che hanno un genoma piccolissimo, spesso hanno geni che codificano per lunghe poliproteine che, dopo la sintesi, devono essere tagliate da un enzima specifico per formare un pool di proteine più piccole perfettamente funzionanti. Le inteine sono un esempio di sintesi di due proteine dallo stesso gene. La prima inteina è stata scoperta nell'enzima ATPasi dei vacuoli di lievito (mostrata qui a destra, file PDB 1jva). Il gene che codifica per questa ATPasi contiene, inserito al suo interno, il codice di un'altra proteina. La proteina composita che viene sintetizzata inizialmente è formata quindi da due proteine una dentro l'altra. La proteina inserita all'interno è chiamata inteina (internal protein, mostrata qui in verde) e i due frammenti della proteina esterna, ATPasi, sono chiamati exteine (external proteins, in rosso e blu). La struttura qui a fianco ha i filamenti delle exteine molto piccoli, ma in realtà sono molto più grandi come è indicato dai puntini. Dopo che la proteina composita è stata sintetizzata, la inteina si stacca dalla catena e congiunge insieme le due exteine, questa reazione è chiamata splicing. Si forma così la catena intera della proteina ospite ATPasi perfettamente funzionante. Endonucleasi di inserimento Molte inteine sono fatte di due parti: una porzione capace di realizzare la reazione di splicing che stacca l'inteina dal resto della catena proteica e unisce le due exteine, e una porzione che agisce da enzima e taglia il DNA. Questo enzima è spesso chiamato endonucleasi di inserimento (homing endonuclease) perchè inserisce un gene in un tratto di DNA che non codifica l'inteina. Le endonucleasi di inserimento agiscono come elementi genetici egoisti infatti hanno un modo di riprodursi aggressivo insinuandosi all'interno di geni estranei. Non tagliano il DNA in corrispondenza di geni che codificano per le inteine, ma tagliano il DNA e inseriscono il gene dell'inteina all'interno di altri geni. Successivamente, i normali meccanismi cellulari di riparazione aggiustano il danno, ma usano come stampo lo stesso gene introdotto dall'inteina. Alla fine, quando il danno è riparato, il gene contiene un tratto estraneo, una sequenza a doppia elica che codifica per l'inteina. Questo, però, non causa problemi perchè l'inteina, che si trova inserita all'interno della proteina ospite, sa staccarsi da questa dopo che è stata sintetizzata restituendo la proteina ospite intatta. Inteine in laboratorio Le inteine sono macchine modulari per lo splicing delle proteine e quindi si sono rivelate utili per le biotecnologie. I ricercatori sono riusciti ad isolare inteine funzionanti da vari tipi di cellule e le hanno ingegnerizzate per ottenere inteine mutate in grado di fare splicing in situazioni nuove e specifiche. Per esempio sono state ottenute inteine ingegnerizzate in grado di legare insieme peptidi marcati con atomi diversi per realizzare indagini NMR o per legare amminoacidi non naturali ad una proteina e persino per legare proteine in punti specifici. Le inteine sono state anche usate per creare proteine cicliche legando insieme i due estremi di una stessa catena proteica. Inteine grandi e piccole  Non
tutte le inteine contengono una nucleasi di inserimento. Alcune varietà,
chiamate mini-inteine, contengono solo la porzione di splicing.
Qui sono illustrati esempi di entrambi i tipi. Sulla sinistra è
mostrata una tipica inteina grande che contiene una endonucleasi di inserimento
che qui è mostrata staccata dalla sua proteina e legata al DNA
(file PDB 1lws). Sulla destra è illustrata
una mini-inteina che si trova nel gene di una girasi batterica (file PDB
1am2). Questa proteina è costituita
solo dalla porzione capace di fare la reazione di splicing. Non
tutte le inteine contengono una nucleasi di inserimento. Alcune varietà,
chiamate mini-inteine, contengono solo la porzione di splicing.
Qui sono illustrati esempi di entrambi i tipi. Sulla sinistra è
mostrata una tipica inteina grande che contiene una endonucleasi di inserimento
che qui è mostrata staccata dalla sua proteina e legata al DNA
(file PDB 1lws). Sulla destra è illustrata
una mini-inteina che si trova nel gene di una girasi batterica (file PDB
1am2). Questa proteina è costituita
solo dalla porzione capace di fare la reazione di splicing. Esplorando la struttura Le due strutture qui sotto mostrano un'inteina contenuta nella ATPasi vacuolare di lievito prima e dopo la reazione di splicing. In entrambi i casi alcuni degli amminoacidi presenti nel sito attivo della inteina sono stati sostituiti per rallentare la reazione e consentire di cristallizzare la proteina con il legando ancora presente al suo interno. . . . . . . . . . . . . . . . 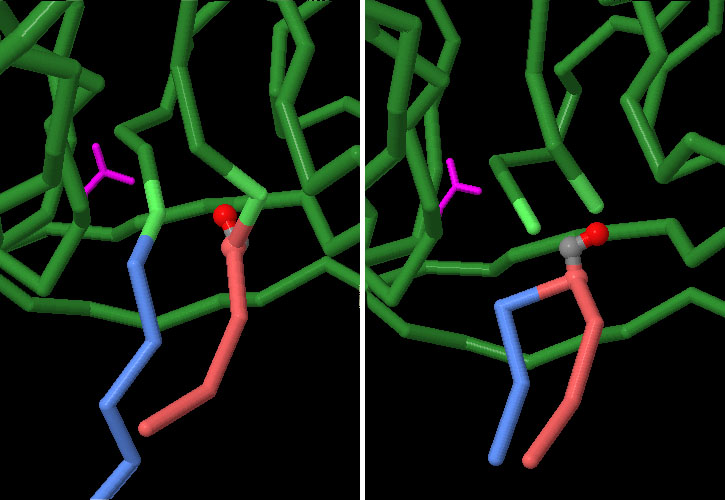 La struttura a sinistra (file PDB 1jva) mostra l'inteina (verde) prima della reazione di splicing, infatti ha i due piccoli segmenti delle exteine (in rosso e blu) ancora attaccati. La struttura a destra (file PDB 1um2) mostra la molecola dopo la reazione di splicing: le due exteine sono state connesse tra di loro. Nella proteina vera le due exteine sono molto più grandi e una volta unite tra loro costituiscono una parte di una complessa pompa protonica. Spunti per ulteriori esplorazioni Fino ad oggi sono state determinate le strutture di molte inteine, sapreste trovarne qualcuna negli archivi PDB? Le inteine che avete individuato includono una endonucleasi di inserimento o sono delle semplici mini-inteine? Le strutture trovate includono anche i due frammenti delle exteine? Perché è difficile isolare strutture che includano le exteine? S. Elleuche, S. Poggeler (2010) Inteins, valuable genetic elements in molecular biology and biotechnology. Applied Microbiology and Biotechnology 87, 479-489. Y. Anraku, Y. Satow (2009) Reflections on protein splicing: structures, functions and mechanisms. Proceedings of the Japan Academy, Series B, 85, 409-421. Y. Anraku, R. Mizutani and Y. Satow (2005) Protein splicing: its discovery and structural insight into novel chemical mechanisms. IUBMB Life 57, 563-574.
|
||||||
|
|
||||||
