|
|
Recettori chimerici |
|||||
|
Molecola del Mese di Ottobre 2017 I linfociti T possono essere ingegnerizzati con recettori chimerici di antigene per attaccare le cellule tumorali  Introduzione IntroduzioneIl nostro sistema immunitario è specializzato nel difenderci da molecole o cellule pericolose, ma di fronte alle cellule tumorali spesso fallisce. Le cellule del cancro sono normali cellule umane che sono diventate maligne. Di solito hanno subìto alcune modifiche genetiche che consentono loro di crescere senza le normali limitazioni. Sfortunatamente molte di queste modifiche genetiche producono proteine mutate dentro la cellula cancerosa e quindi il sistema immunitario non riesce ad individuarle. Oggi i ricercatori stanno sviluppando nuovi metodi per restituire al sistema immunitario gli strumenti per combattere specifiche forme di cancro. Linfociti T ingegnerizzati I linfociti T hanno la capacità di riconoscere le cellule infettate da virus usando specifici recettori per poi ucciderle. Sfortunatamente i linfociti T non sono così efficaci con le cellule tumorali perchè le molecole sulla superficie delle cellule del cancro spesso sembrano identiche a quelle di cellule sane. I recettori chimerici di antigene (CAR) costituiscono un nuovo modo per i medici per armare i linfociti T della capacità di riconoscere e uccidere le cellule tumorali. I ricercatori prelevano linfociti T da un malato di cancro e aggiungono il gene per la produzione di un CAR che sappia riconoscere le sue specifiche cellule tumorali. Quando questi linfociti CART vengono introdotti nel paziente, cercano le cellule tumorali e le distruggono. Costruire un CAR I recettori chimerici di antigene sono molto complessi e vengono costruiti legando insieme più frammenti di proteine diverse per svolgere una serie di funzioni. Un frammento variabile di anticorpo a singola catena (Fv) riconosce una proteina nota di una cellula tumorale. Il frammento Fv è ingegnerizzato a partire da anticorpi monoclonali usando solo i due domini sulla punta dell'anticorpo e collegandoli tra loro con un linker flessibile. Questa porzione di anticorpo viene legata ad un segmento transmembrana con un'altra catena flessibile. All'interno della cellula vi sono uno o più frammenti di proteine di segnalazione che hanno lo scopo di attivare il linfocita T quando ha individuato la cellula tumorale. Nella figura qui sopra si vede un recettore chimerico composto dai pezzi di quattro molecole: una unità di un anticorpo a singola catena Fv (in rosa, file PDB 2kh2) posto fuori dalla membrana cellulare, un filamento flessibile transmembrana presente come dimero costituito da due catene CD3 zeta-zeta (file PDB 2hac) capace di segnalare all'interno della cellula il legame dell'anticorpo col suo legando, e due domini della proteina di segnalazione ZAP70 legati in tandem (nei toni del blu, file PDB 2oq1, e 2ozo).  CART
in azione CART
in azioneLa terapia CART "tisagenlecleucel" è stata approvata recentemente dalla FDA statunitense per il trattamento di una forma di leucemia particolarmente comune nei bambini. In questa forma di leucemia conosciuta come ALL (leucemia linfoblastica acuta), le normali cellule B si trasformano in cellule cancerose che non riescono a svilupparsi correttamente. La terapia CART usa come bersaglio la proteina CD19 che si trova normalmente sulla superficie delle cellule B, e anche su quelle trasformate in cellule leucemiche. I recettori chimerici di antigene di ultima generazione sono un po' più avanzati di quello mostrato qui sopra. I linfociti T ingegnerizzati si sono rivelati molto efficaci con questo tipo di cancro e hanno portato alla completa guarigione della maggior parte dei piccoli pazienti trattati. Nella figura qui a fianco è mostrata una ricostruzione artistica di un linfocita T ingegnerizzato (a sinistra in blu) che sta riconoscendo e attaccando una cellula leucemica (a destra in verde). La molecola CAR è mostrata in rosso, legata alla proteina CD19 sulla superficie della cellula leucemica. Questo legame ha portato all'attivazione del linfocita T che rilascia perforina (viola) una proteina che crea dei pori nella membrana cellulare. Dei granzimi (magenta, proteasi alla serina) entrano nella cellula leucemica attraverso questi pori e innescano il processo di apoptosi, la morte cellulare programmata.  Esplorando
la struttura Esplorando
la strutturaGli anticorpi a singola catena vengono creati ingegnerizzando un linker che unisca le due catene pesante (VH) e leggera (VL) di un anticorpo monoclonale. In genere si usano solo le porzioni finali variabili dell'anticorpo (VH e VL) e il linker è formato da una catena proteica flessibile formata solo di glicina e serina (magenta). L'anticorpo a singola catena mostrato qui a fianco (file PDB 2kh2) è legato ad una citochina (interleukina-1 beta, azzurra) che è riconosciuta dall'azione combinata delle due metà dell'anticorpo VH e VL. Spunti per ulteriori esplorazioni Ci sono molte strutture di anticorpi a singola catena Fv negli archivi PDB. Esaminandoli scoprirete che molti di questi non contengono le coordinate atomiche degli atomi del linker che unisce le due catene. Sapreste dire perchè? Per conoscere di più sulle molecole citotossiche dei linfociti T, cercate negli archivi PDB le strutture delle due molecole citate sopra: le perforine e i granzimi. 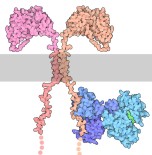 Bibliografia BibliografiaFDA Briefing Document BLA 125646, Tisagenlecleucel, Novartis Pharmaceuticals Corporation. ZL Chang, YY Chen (2017) CARs: Synthetic immunoreceptors for cancer therapy and beyond. Trends in Molecular Medicine 23, 430-450. MH Kershaw, JA Westwood & PK Darcy (2013) Gene-engineered T cells for cancer therapy. Nature Reviews Cancer 13, 525-541. 2kh2: IC Wilkinson, CJ Hall, V Veverka, JY Shi, FW Muskett, PE Stephens, RJ Taylor, AJ Henry & MD Carr (2009) High resolution NMR-based model for the structure of a svFv-IL-1beta complex. Journal of Biological Chemistry 284, 31928-31935. 2ozo: S Deindl, TA Kadlecek, T Brdicka, X Cao, A Weiss & J Kuriyan (2007) Structural basis for the inhibition of tyrosine kinase activity of ZAP-70. Cell 129, 735-746. 2hac: ME Call, JR Schnell, C Xu, RA Lutz, JJ Chou & KW Wucherpfennig (2006) The structure of the zetazeta transmembrane dimer reveals features for its assembly with the T cell receptor. Cell 127, 355-368. 2oq1: MH Hatada, X Lu, ER Laird, J Green, JP Morgenstern, M Lou, C Marr, TB Phillips, MK Ram & K Theriault (1995) Molecular basis for the interaction of ZAP-70 with the T-cell receptor. Nature 377, 32-38.
|
||||||
|
|
||||||
