|
Molecola del mese
di novembre 2019
La fosfolipasi A2 taglia i fosfolipidi di membrana liberando acido arachidonico
che contribuisce alla segnalazione dell'infiammazione e del dolore
 Introduzione Introduzione
Più di cento anni fa i ricercatori hanno scoperto che un enzima
del veleno di serpente tagliava i fosfolipidi delle membrane cellulari.
Da allora, i ricercatori hanno scoperto enzimi simili in molti altri
posti. Alcune fosfolipasi A2 vengono secrete all'esterno delle cellule
come quella prodotta dal pancreas per la digestione nell'intestino.
Altre sono prodotte all'interno della cellula dove contribuiscono alla
sintesi di molecole di segnalazione. Tutte queste fosfolipasi hanno
un'azione simile: staccare l'acido Arachidonico legato al carbonio
2 dei fosfolipidi (A2).
Piccoli e robusti
Le fosfolipasi di veleno di serpente e quelle pancreatiche sono enzimi
piccoli che devono resistere all'ambiente ostile che trovano fuori dalle
cellule quando vengono secreti. La loro struttura tridimensionale è
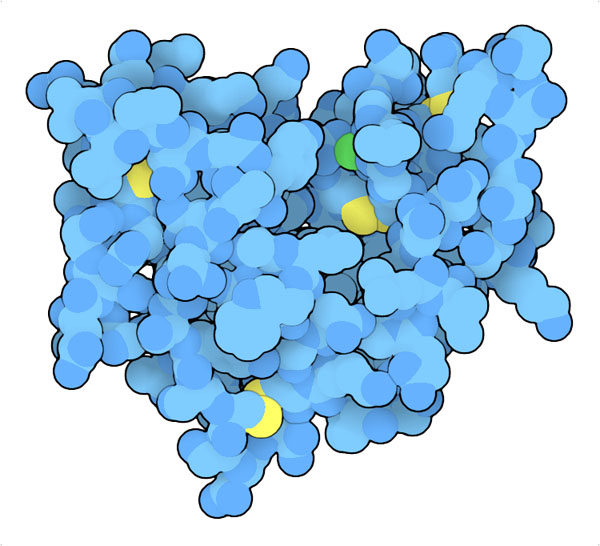
mantenuta stabile da un insieme di ponti disolfuro. L'enzima mostrato
qui a fianco e qui sotto, prodotto dal pancreas di bue (file PDB 1bp2),
ha sette ponti disolfuro (gialli). Il sito attivo si trova in una tasca
su un lato della proteina e contiene uno ione calcio (verde, trattenuto
da un acido aspartico) che aiuta la reazione di taglio promossa dall'istidina
sul fondo del sito attivo (anello con due atomi di azoto blu).
. . . . . . .. . . . . 
Risposta infiammatoria
Le catene di acido arachidonico staccate dalla fosfolipasi A2 sono usate
per la sintesi di molecole di segnalazione dell'infiammazione e del
dolore: le prostaglandine (per opera della cicloossigenasi
mdm 5-2001) e i leucotrieni. La loro funzione è quindi
molto delicata e un loro funzionamento anomalo può portare a
malattie gravi come l'aterosclerosi, l'artrite reumatoide
e il morbo di Crohn. La comunità scientifica sta usando
le strutture note di fosfolipasi per scoprire nuovi farmaci che combattano
queste malattie bloccando l'azione dell'enzima. Finora, però,
nessuno degli farmaci trovati ha raggiunto il mercato perchè
mancavano di selettività per le sole fosfolipasi A2. Qui sotto
è mostrato un nuovo farmaco (azzurro) che si sta rivelando più
promettente (file PDB 5y5e).

 Dentro
e fuori Dentro
e fuori
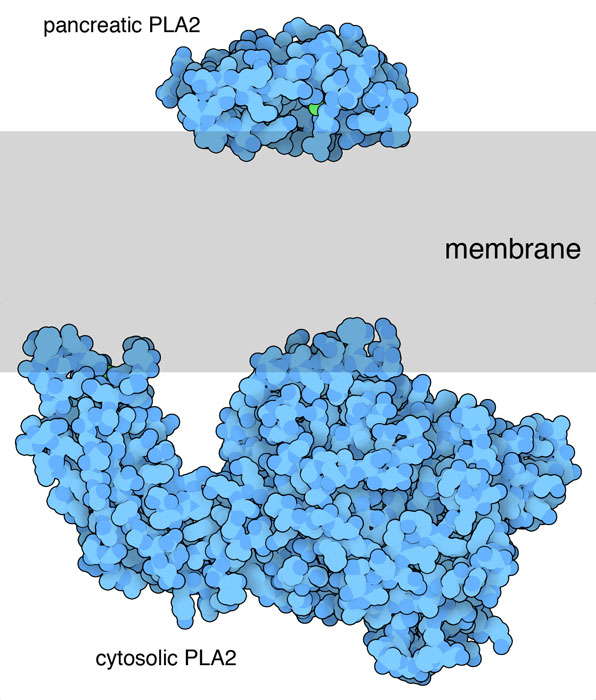
Esistono fosfolipasi con strutture molto diverse tra loro che svolgono
funzioni diverse. Le fosfolipasi A2 che vengono secrete sono piccole
(come quella pancreatica mostrata qui a fianco in alto, file PDB 1bp2),
mentre quelle prodotte nel citoplasma sono più grandi e hanno
domini distinti per legarsi alla membrana e per catalizzare la reazione
di taglio, come quella mostrata qui a fianco in basso (file PDB 1cjy).
Tutte le fosfolipasi A2 hanno regioni che interagiscono con la superficie
della membrana e consentono all'enzima di estrarre i fosfolipidi che
contengono acido arachidonico e di staccarlo.
 Esplorando
la struttura Esplorando
la struttura
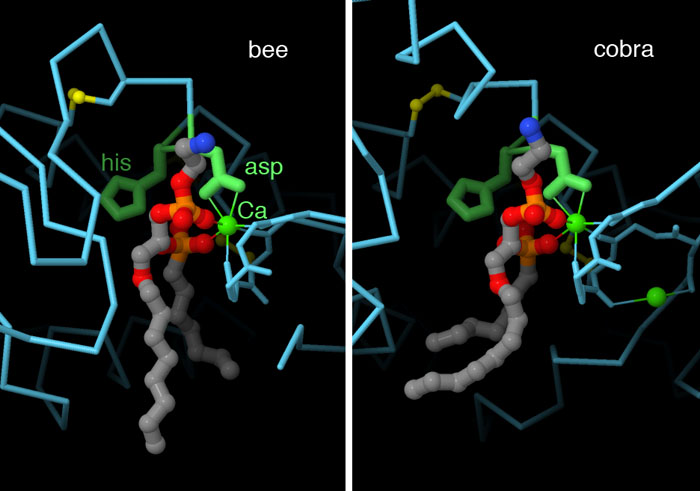
Qui a lato sono mostrate due fosfolipasi contenute in due diversi veleni,
una nel veleno di ape (file PDB 1poc)
e una nel veleno di cobra (PDB entry 1pob).
Anche se i due enzimi hanno strutture diverse, nel sito attivo hanno
un gruppo di amminoacidi molto simile. In particolare hanno una istidina
(his) che attacca il legame estere tra il fosfolipide e l'acido arachidonico
sul C2 (la catena grigia sul fondo) ed un acido aspartico (asp)
che lega uno ione calcio che aiuta la reazione interagendo con
gli ossigeni dell'acido arachidonico) . Nelle due figure qui
a lato, nel sito attivo non è legato un vero fosfolipide, ma
un suo analogo che resiste alla reazione di taglio e così ci
mostra come le molecole si legano nel sito attivo per realizzare la
reazione.
Spunti per ulteriori esplorazioni
Alcune forme di fosfolipasi A2 si associano per formare complessi più
grandi, ma non è chiaro se questi abbiano una funzione biologica.
Cercate il file PDB 1psh per esaminare
la forma trimera della tossina di cobra.
Negli archivi PDB si trovano anche alcune strutture di fosfolipasi che
contengono dei farmaci sperimentali. Cercatene alcune nel sito PDB cercando
"Phospholipase A2"
 Bibliografia Bibliografia
Dennis, E.A., Cao, J., Hsu, Y.-H., Magrioti, V., Kokotos, G.
(2011) Phospholipase A2 enzymes: physical structure, biological function,
disease implication, chemical inhibition, and therapeutic intervention.
Chem. Rev. 111: 6130-6185.
1c1j: Zhang, H.-l., Zhang, Y.-Q., Song, S.-Y., Zhou, Y., Lin,
Z.-J. (1999) Structure of Cadmium-substituted Phospholipase A2 from
Agkistrodon halys Pallas at 2.8 Angstroms Resolution. Protein Pept.
Lett. 6: 185-193.
1pob, 1poc: Scott, D.L., Otwinowski, Z., Gelb, M.H., Sigler,
P.B. (1990) Crystal structure of bee-venom phospholipase A2 in a complex
with a transition-state analogue. Science 250: 1563-1566.
1bp2: Dijkstra, B.W., Kalk, K.H., Hol, W.G., Drenth, J. (1981)
Structure of bovine pancreatic phospholipase A2 at 1.7A resolution.
J. Mol. Biol. 147: 97-123.
|
|
|