|
|
Cisplatino e DNA | |||||
|
Molecola del mese di marzo 2021 Il cisplatino cura il cancro danneggiando il DNA delle cellule cancerose. 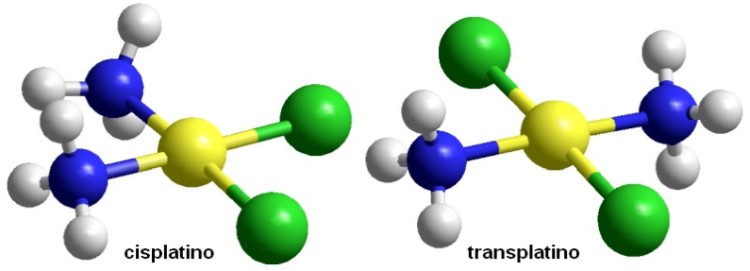 Introduzione IntroduzioneIl cisplatino è una piccola molecola planare che contiene un atomo di platino legato a due gruppi amminici (blu) posti dallo stesso lato (cis) e a due atomi di cloro (verdi). Questa molecola ha stupito il mondo scientifico, negli anni '70, perchè ha aumentato dal 10% all'85% l'efficacia delle cure per alcuni tipi di tumore come quello dei testicoli. Il cisplatino crea un legame crociato nel DNA legando, al posto dei due atomi di cloro, due atomi di azoto di due basi di guanina consecutive. Questo legame crociato fa piegare il DNA, ne ostacola il normale funzionamento e così danneggia la cellula. Oltre al cancro dei testicoli, il cisplatino è stato uno dei primi farmaci approvati per il trattamento del cancro delle ovaie, del collo dell'utero, della vescica, del seno, del tessuto connettivo, della testa e del collo. Una molecola simile, il transplatino, non è attiva come farmaco. Cisplatino in azione 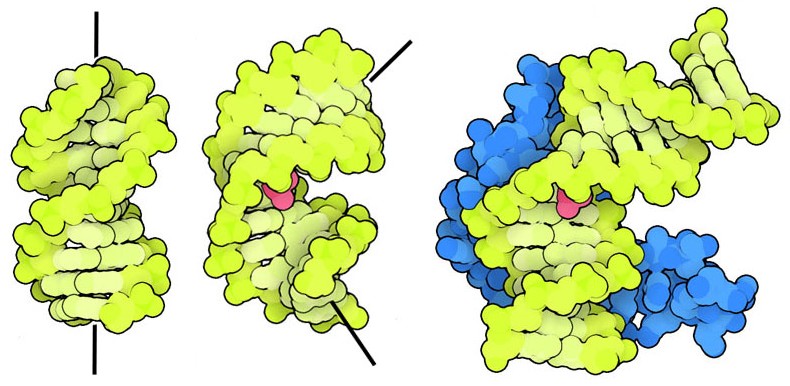 Il
cisplatino danneggia la cellula cambiando la conformazione del DNA e quindi
cambiando il modo in cui questo interagisce con le proteine. Come si vede
qui a fianco, il normale DNA (file PDB 3dnb)
è diritto, mentre il DNA legato al cisplatino (file PDB 3lpv)
è piegato nel punto in cui il cisplatino (rosso) lo ha modificato
chimicamente. Il
cisplatino danneggia la cellula cambiando la conformazione del DNA e quindi
cambiando il modo in cui questo interagisce con le proteine. Come si vede
qui a fianco, il normale DNA (file PDB 3dnb)
è diritto, mentre il DNA legato al cisplatino (file PDB 3lpv)
è piegato nel punto in cui il cisplatino (rosso) lo ha modificato
chimicamente. Le proteine HMG (high mobility group) che si legano al DNA, si legano preferenzialmente al DNA piegato e quindi si legano al DNA piegato dal cisplatino come si vede qui a fianco nella terza figura (file PDB 1ckt). La proteina HMG (blu) impedisce al DNA danneggiato dal cisplatino di interagire con le proteine coinvolte nella duplicazione, nella trascrizione e nella riparazione del DNA. Questa inaccessibilità del DNA attiva i meccanismi di apoptosi, o morte programmata della cellula.  Cellule
resistenti Cellule
resistentiIl cisplatino è molto efficace nel trattamento di molti tipi di tumore, ma questi possono sviluppare una resistenza al cisplatino. Per esempio, le cellule tumorali possono imparare ad espellere il cisplatino oppure possono cambiare i meccanismi che regolano l'apoptosi. I biochimici, studiando le strutture delle molecole coinvolte, hanno scoperto nuovi farmaci che riescono ad aggirare la resistenza e che hanno dimostrato un'efficacia maggiore e una minore tossicità. Una di queste molecole è l'ossaliplatino, mostrato qui a fianco, che si è dimostrato efficace nel trattamento di alcuni tumori che avevano acquisito resistenza al cisplatino. Al posto dei due atomi di cloro vi sono i due ossigeni (rossi) dell'acido ossalico, inoltre ai due gruppi amminici è stato legato un anello di cicloesano. Qui sotto è mostrato in dettaglio il legame crociato che l'ossaliplatino realizza tra gli atomi di azoto di due guanine consecutive in un filamento di DNA (file PDB 2kou). Le guanine si sono legate al platino sostituendo i due ossigeni dell'acido ossalico, il platino (giallo), poi, è legato ai due gruppi amminici uniti ad un anello di cicloesano. .. .  Nella figura seguente, invece, è mostrato in dettaglio il legame realizzato dal cisplatino col DNA (file PDB 1ckt) . Sul platino sono rimasti i due gruppi amminici: le due guanine si sono legate al platino al posto dei due atomi di cloro. . . 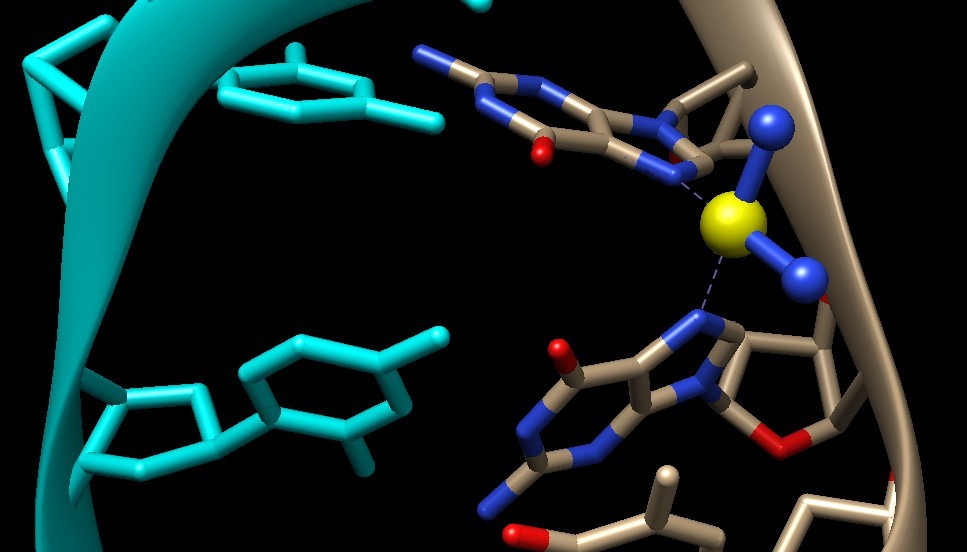
 Bloccare
le proteine Bloccare
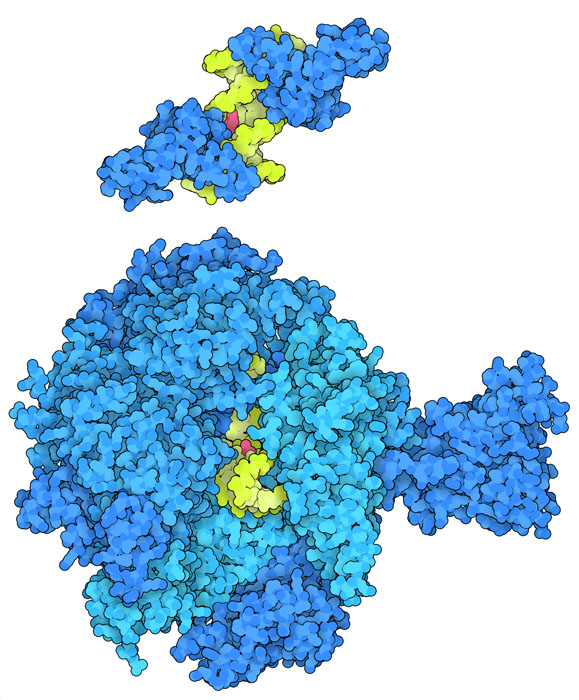
le proteineIl DNA legato al cisplatino ostacola il normale funzionamento delle proteine coinvolte nella riparazione e nella trascrizione del DNA. Il processo NER di riparazione e rimozione di nucleotidi di solito rimuove le strutture anormali e deformate (chiamate lesioni) che sono provocate da reattivi chimici o dalle radiazioni UV e agisce tagliando ed eliminando il segmento alterato del DNA. Per esempio, la proteina NER XPA si lega al DNA piegato sia a monte sia a valle dell'elica danneggiata come si vede qui a fianco in alto (file PDB 5a39). Poi XPA inserisce un tratto di catena, con struttura beta a forcina, tra i filamenti di DNA e così li separa ottenendo una regione a singolo filamento. Questo permette ad altre proteine NER di legarsi e rimuovere la lesione. Queste difese, però, vengono bloccate quando le proteine HMG si legano al complesso cisplatino-DNA e così il tratto danneggiato non può essere riparato. Il DNA legato al cisplatino impedisce anche alla RNA polimerasi II (file PDB 2r7z) di trascrivere il DNA genomico in RNA come si vede nell'immagine qui a lato. La regione del DNA ingrossata dal cisplatino è arrivata all'enzima, ma si è incastrata e non può arrivare al sito attivo dove avviene la trascrizione.  DNA
Polimerasi: amica o nemica? DNA
Polimerasi: amica o nemica?Gli eucarioti usano una speciale DNA polimerasi per superare lesioni come quelle del cisplatino o altri tratti danneggiati come i legami crociati provocati dalle radiazioni UV. Le cellule cancerose, però, possono sfruttare questi meccanismi per diventare resistenti al cisplatino. Un esempio è la DNA polimerasi eta (mostrata qui a fianco dal file PDB 2r8k) una polimerasi di riparazione che è in grado di superare le lesioni del DNA e che di solito aiuta le cellule a sopravvivere dopo un'esposizione ai raggi UV che forma dimeri di timina (mdm 7-2007). Le cellule cancerose, però, possono usare questo enzima per replicare il DNA scavalcando la lesione provocata dal cisplatino. Anche la DNA polimerasi kappa, mostrata qui a destra, può aiutare a superare la lesione del DNA piegato dal cisplatino (file PDB 6bs1). Si stanno studiando farmaci che ne blocchino l'azione per superare la resistenza delle cellule tumorali. Esplorando la struttura 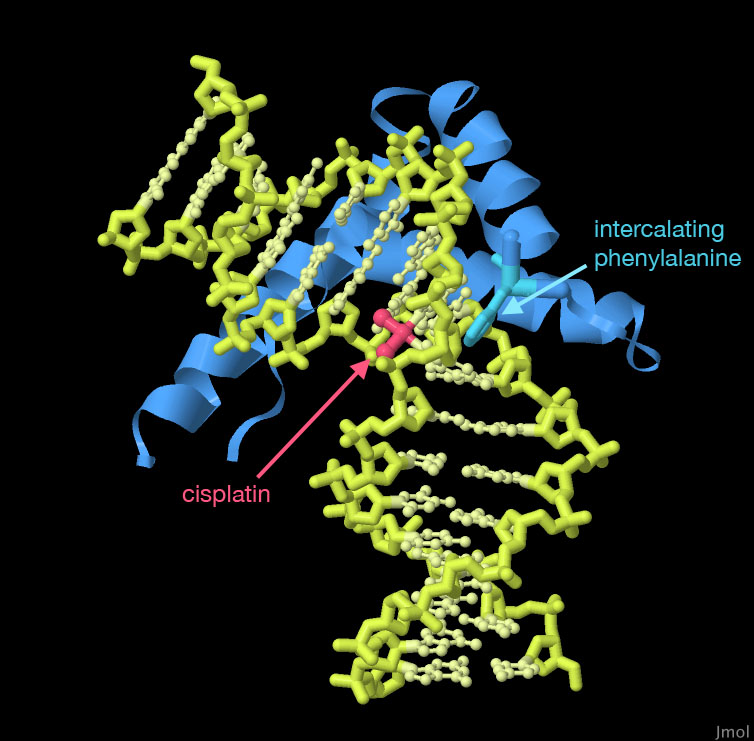 Quando
il cisplatino entra nella cellula e poi nel nucleo, gli atomi di azoto
di due guanine consecutive sul DNA attaccano il cisplatino sostituendo
prima uno, poi l'altro dei due atomi di cloro. Si formano così
due legami covalenti tra le guanine e il platino che costringono il DNA
a piegarsi. Quando
il cisplatino entra nella cellula e poi nel nucleo, gli atomi di azoto
di due guanine consecutive sul DNA attaccano il cisplatino sostituendo
prima uno, poi l'altro dei due atomi di cloro. Si formano così
due legami covalenti tra le guanine e il platino che costringono il DNA
a piegarsi. Nell'immagine qui a fianco si vede la struttura del file PDB 1ckt che include un breve tratto di DNA duplex, una lesione con cisplatino e un breve tratto di una proteina HMG (blu), quello che si lega al DNA. Anche le proteine HMG piegano il DNA quando vi si legano. Notate che la proteina HMG sta intercalando una fenilalanina (ciano) nell'elica del DNA proprio nel sito dove il DNA è piegato dal cisplatino. Spunti per ulteriori esplorazioni Uno degli effetti collaterali del cisplatino è quello di indurre la rapida degradazione del Trasportatore 1 del rame(I) (Cu+) riducendo così anche l'ingresso di cisplatino nella cellula e aumentando la resistenza al farmaco. Esplorate il trasportatore 1 del rame nel file PDB 6m97. L'enzima glutatione transferasi è una proteina che si lega al cisplatino e così ne impedisce l'azione sul DNA. Potete trovare questo enzima nel file PDB 5djl. 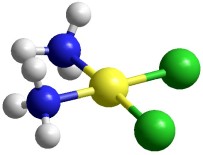 Bibliografia Bibliografia5djl: De Luca, A., Parker, L.J., Ang, W.H., Rodolfo, C., Gabbarini, V., Hancock, N.C., Palone, F., Mazzetti, A.P., Menin, L., Morton, C.J., Parker, M.W., Lo Bello, M., Dyson, P.J. (2019) A structure-based mechanism of cisplatin resistance mediated by Glutathione Transferase P1-1. Proc Natl Acad Sci U S A 116, 13943-13951 6m97: Ren, F., Logeman, B.L., Zhang, X., Liu, Y., Thiele, D.J., Yuan, P. (2019) X-ray structures of the high-affinity copper transporter Ctr1. Nat Commun 10: 1386-1386 6bs1: Jha, V., Ling, V. (2018) Structural basis for human DNA polymerase kappa to bypass cisplatin intrastrand cross-link (Pt-GG) lesion as an efficient and accurate extender, J Mol Biol 430: 1577-1589 5a39: Koch, S.C., Kuper, J., Gasteiger, K.L., Simon, N., Strasser, R., Eisen, D., Geiger, S., Schneider, S., Kisker, C., Carell, T. (2015) Structural insights into the recognition of cisplatin and Aaf-Dg lesion by Rad14 (Xpa). Proc Natl Acad Sci U S A 112: 8272-8277 Dasari S., Tchounwou P.B. (2014) Cisplatin in cancer therapy: molecular mechanisms of action. Eur J Pharmacol. 740: 364-378 Shen, D. W., Pouliot, L. M., Hall, M. D., Gottesman, M. M. (2012). Cisplatin resistance: a cellular self-defense mechanism resulting from multiple epigenetic and genetic changes. Pharmacol Rev 64: 706-721 3lpv: Todd, R.C., Lippard, S.J. (2010) Structure of duplex DNA containing the cisplatin 1,2-{Pt(NH(3))(2)}(2+)-d(GpG) cross-link at 1.77A resolution. J Inorg Biochem 104: 902-908 2r8k: Alt A., Lammens K., Chiocchini C., Lammens A., Pieck J.C., Kuch D., Hopfner K.P., Carell T. (2007) Bypass of DNA lesions generated during anticancer treatment with cisplatin by DNA polymerase eta. Science. 318: 967-970 2r7z: Damsma, G.E., Alt, A., Brueckner, F., Carell, T., Cramer, P. (2007) Mechanism of transcriptional stalling at cisplatin-damaged DNA. Nat Struct Mol Biol 14, 1127-1133 Cohen, S.M., Lippard, S.J. (2001). Cisplatin: from DNA damage to cancer chemotherapy. Prog Nucl Acid Res Mol Biol 67, 93-130 Kelland, L. (2007) The resurgence of platinum-based cancer chemotherapy. Nat Rev Cancer 7: 573-584 1ckt: Ohndorf, U.-M., Rould, M.A., Pabo, C.O., Lippard, S.J. (1999) Basis for recognition of cisplatin-modified DNA by high-mobility-group proteins. Nature 399: 708-712 Takahara P.M., Rosenzweig A.C., Frederick C.A., Lippard S.J. (1995) Crystal structure of double-stranded DNA containing the major adduct of the anticancer drug cisplatin. Nature 377: 649-52 3dnb: Prive, G.G., Yanagi, K., Dickerson, R.E. (1991) Structure of the B-DNA decamer C-C-A-A-C-G-T-T-G-G and comparison with isomorphous decamers C-C-A-A-G-A-T-T-G-G and C-C-A-G-G-C-C-T-G-G. J Mol Biol 217: 177-199
|
||||||
|
|
||||||
