|
|
Caseina chinasi del Golgi | |||||
|
Molecola del mese di gennaio 2022 La caseina e molte altre proteine vengono fosforilate dalla caseina chinasi del Golgi  Introduzione IntroduzioneLa maggior parte delle prime scoperte in biochimica è stata fatta studiando proteine facili da ottenere e purificare. Per esempio, le prime strutture di proteine sono state determinate usando la mioglobina che era particolarmente abbondante nel muscolo di balena e l'emoglobina che è facilmente purificabile dal sangue. Alla fine del 1800 gli scienziati hanno scoperto che la caseina, la proteina più abbondante del latte, contiene fosforo. Indagini successive hanno rivelato che questo fosforo apparteneva a gruppi fosfato legati ad amminoacidi di serina. Da allora sono state scoperte molte altre fosfoproteine e una varietà di chinasi, che aggiungono i gruppi fosfato alle proteine, e di fosfatasi che li tolgono. Chinasi ovunque Se si fa una ricerca per "caseina chinasi" negli archivi PDB, si trova una lista lunghissima di proteine. Il nome di queste chinasi, però, è fuorviante. Vengono chiamate caseina chinasi perché sono state scoperte grazie alla loro capacità di fosforilare la caseina, ma per la maggior parte di esse questa non è la funzione biologica. Piuttosto, hanno un ruolo importante di segnalazione nel citoplasma e quindi entrano solo raramente in contatto con la caseina che è secreta dall'apparato del Golgi. La vera chinasi che fosforila la caseina del latte è stata scoperta solo nel 2012. L'autentica caseina chinasi La caseina chinasi del Golgi, mostrata qui dal file PDB 5yh2, aggiunge gruppi fosfato alla caseina e a molte altre proteine che vengono secrete. La sua forma attiva è un complesso di due proteine simili. La subunità catalitica è chiamata Fam20C (blu). Si lega alla caseina e trasferisce un gruppo fosfato dall'ATP (magenta) alla proteina. La seconda subunità, Fam20A (verde), non è catalitica, ma si lega a Fam20C e la rende più attiva. Per questo è anche chiamata pseudochinasi, perché è strutturalmente simile ad una chinasi ma non ha attività catalitica. Vi è una terza proteina simile a queste due, Fam20B che, però, aggiunge gruppi fosfato agli zuccheri.  La
caseina nel latte La
caseina nel latteIl latte è composto da un insieme complesso di proteine, grassi e altri nutrienti che forniscono tutto quello di cui un neonato ha bisogno per crescere. La maggior parte delle proteine del latte vaccino è costituita dalla caseina, mentre nel latte umano ce n'è di meno. La caseina è formata da catene con una struttura variabile (per questo non la trovate negli archivi PDB) e si associa in grandi micelle nel latte. Le catene di caseina hanno regioni che sono altamente fosforilate e si legano con piccolissimi cristalli (nanocluster) di calcio e fosfato nella micella. Le porzioni rimanenti delle catene di caseina sono idrofobiche e si avvicinano tra loro. Una caseina specializzata, chiamata caseina kappa, riveste la superficie della micella. La porzione esterna della caseina kappa è carica negativamente ed è glicosilata e questo rende l'intera micella solubile in acqua. Latte e formaggio Alcune note proprietà del latte dipendono dalla struttura micellare della caseina. Le grandi micelle, insieme con le goccioline di grasso, diffondono la luce e quindi rendono il latte opaco e bianco. Anche il processo di produzione del formaggio sfrutta la struttura delle micelle. Il latte è trattato con il caglio che contiene enzimi che tagliano in molti punti la caseina kappa. Le micelle con la caseina tagliata non sono più così solubili e si aggregano in coaguli. Le altre proteine del latte, come le albumine, rimangono nel siero liquido. Nella figura a fianco si vedono in sezione una micella di caseina (al centro in basso) e un globulo di grasso (giallo, in alto). La micella contiene molte caseine alfa e beta non strutturate che legano nanocluster di calcio e fosfato, e intorno si vedono molecole di caseina kappa che fanno sporgere verso l'esterno le loro catene polari. Il globulo di grasso è circondato da una membrana a più strati nella quale sono incorporate proteine (scure), molecole di lipidi (gialle) e caroteni (arancioni). Le proteine del siero sono mostrate con un colore più scuro attorno alla micella. 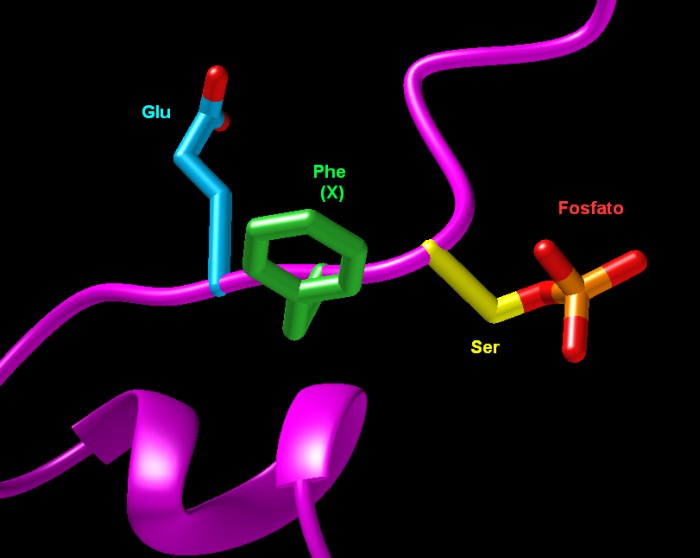 Esplorando
la struttura Esplorando
la strutturaSerina fosforilata La caseina chinasi del Golgi aggiunge gruppi fosfato alle proteine in corrispondenza della sequenza S-X-E, dove S è la serina alla quale viene aggiunto il fosfato, X è un amminoacido qualsiasi ed E è l'acido glutammico. L'enzima può fosforilare la serina anche se, al posto dell'acido glutammico, vi è un'altra serina già fosforilata nella posizione E. Nella figura (file PDB 2lid) si vede un esempio di questa sequenza con il fosfato già aggiunto alla serina. Questa sequenza appartiene alla vitellogenina, una proteina altamente fosforilata che si trova nel tuorlo d'uovo degli organismi ovipari. Quella mostrata qui è la vitellogenina di ape mellifera AmVg. La sua elevata fosforilazione nei tratti ricchi di serina la rende resistente all'azione degli enzimi proteolitici. Spunti per ulteriori esplorazioni Potete confrontare le strutture di Fam20C (catena B in 5yh2) e di Fam20A (catena A in 5yh2) usando lo strumento "Pairwise Structure Alignment Tool". Confrontate queste sequenze anche con Fam20B (catena A in 5xoo). Negli archivi PDB ci sono molte strutture di proteine che contengono serina fosforilata. Per trovarle, cercate "phosphoserine" o SEP e cliccate su "present in a polymer sequence". Worby, C.A., Mayfield, J.E., Pollack, A.J., Dixon, J.E., Bannerjee, S. (2021) The ABCs of the atypical Fam20 secretory pathway kinases. J Biol Chem 296: 100267 Roy, D., Ye, A., Moughan, P.J., Singh, H. (2020) Composition, structure, and digestive dynamics of milk from different species. Front. Nutrition 7: 577759 5yh2: Zhang, H., Zhu, Q., Cui, J., Wang, Y., Chen, M.J., Guo, X., Tagliabracci, V.S., Dixon, J.E., Xiao, J. (2018) Structure and evolution of the Fam20 kinases. Nat Commun 9: 1218-1218 2lid: Havukainen, H., Underhaug, J., Wolschin, F., Amdam, G., Halskau, O. (2012) A vitellogenin polyserine cleavage site: highly disordered conformation protected from proteolysis by phosphorylation. J Exp Biol 215: 1837-184 |
||||||
|
|
||||||
