|
|
Ialuronidasi |
|||||
|
Molecola del mese di marzo 2024 Le nostre cellule sintetizzano lunghe catene di carboidrati per rendere il nostro corpo più flessibile e resistente. 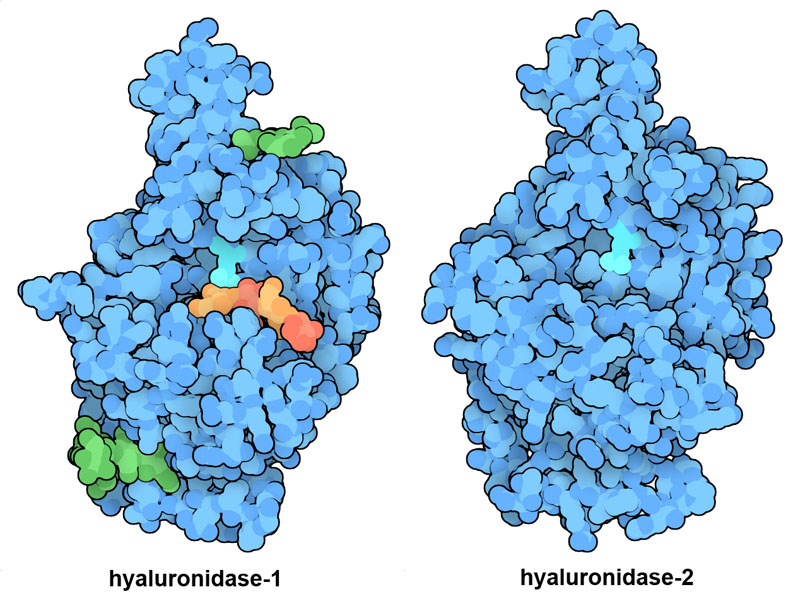 Introduzione IntroduzioneIl nostro corpo è formato da migliaia di miliardi di cellule che lavorano insieme per compiere tutte le funzioni biologiche necessarie alla vita. Queste cellule non sono legate in modo rigido come mattoni, ma sono unite da uno strato robusto e flessibile di tessuto connettivo per consentire al nostro corpo di muoversi, di respirare e di riparare i danni che subisce. L'acido ialuronico è un componente essenziale del tessuto connettivo. E' un carboidrato a lunga catena formato da una successione di due zuccheri semplici. Come molti carboidrati può assorbire una grande quantità di acqua pari a migliaia di volte il suo peso per formare un gel flessibile e appiccicoso. Nel tessuto connettivo questo gel si combina in diverse proporzioni con elementi più rigidi, come il collagene, per creare una serie di materiali, dai foglietti resistenti che legano insieme le cellule, ai liquidi viscosi che lubrificano le articolazioni. Tagliare i carboidrati Le nostre cellule producono diversi enzimi per tagliare le catene di acido ialuronico quando questo non è più necessario. L'enzima ialuronidasi-2 (mostrato in alto secondo un modello calcolato al computer Model-Hyal-2) è il primo ad intervenire rompendo la lunga catena dell'acido ialuronico in pezzi di media dimensione. Poi, un altro enzima ialuronidasi-1 (file PDB 2pe4) rompe queste sequenze in piccoli frammenti di quattro zuccheri. Infine, altri due enzimi rompono i frammenti in zuccheri semplici. Nella figura qui sopra a sinistra si vede l'acido glutammico del sito catalitico in azzurro chiaro, mentre in arancione è mostrato lo spezzone di quattro zuccheri che si forma. Acido ialuronico L'acido ialuronico è un polisaccaride costituito da una lunga catena nella quale due zuccheri si alternano in sequenza: N-acetiglucosammina e acido glucuronico. Il seguente schema mostra questa struttura in 2D. . . . . . . . . . 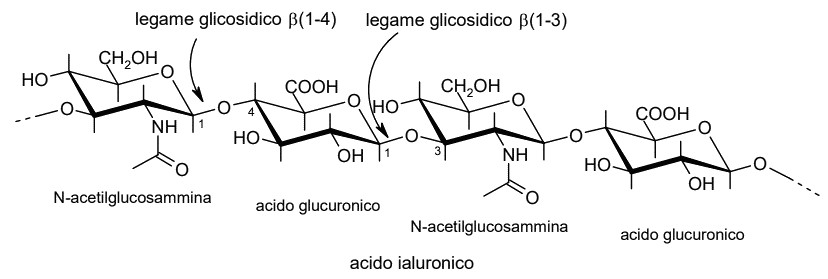
Nella figura seguente è mostrata la catena dell'acido ialuronico in 3D dal file PDB 2hya. Le sfere viola sono ioni sodio . . . . . . 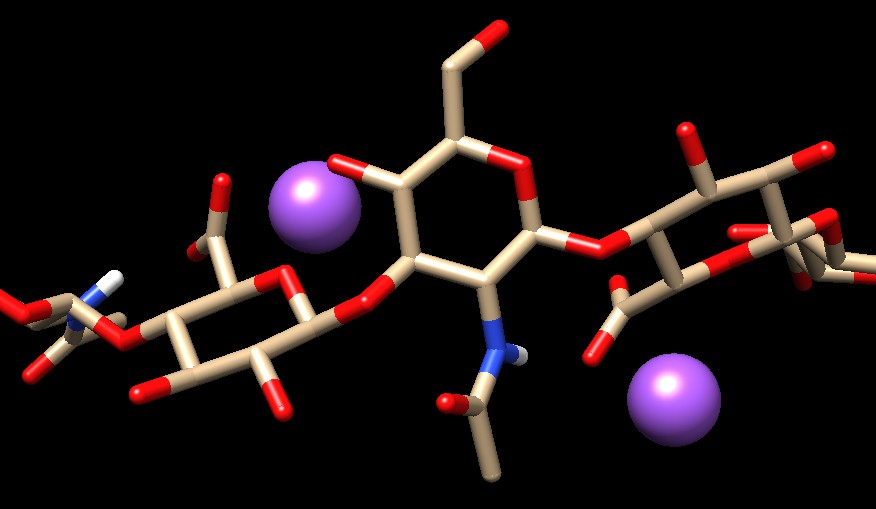
Riciclare è utile E' interessante notare che il nostro acido ialuronico viene continuamente riciclato. Ogni giorno, circa un terzo delle catene di acido ialuronico viene degradato e poi ricostruito per soddisfare alle diverse necessità del nostro corpo. L'acido ialuronico svolge molti ruoli importanti per la salute. Aiuta a collegare le nuove cellule che si formano negli embrioni in crescita, favorisce la guarigione delle ferite e aiuta le cellule mobili a raggiungere la loro meta nel nostro corpo. Come vedremo più avanti, aiuta anche gli spermatozoi a fecondare l'ovulo. Sfortunatamente l'acido ialuronico ha anche un lato oscuro, aiuta le cellule cancerose a spostarsi dal tumore originario in altre parti del corpo per formare metastasi. 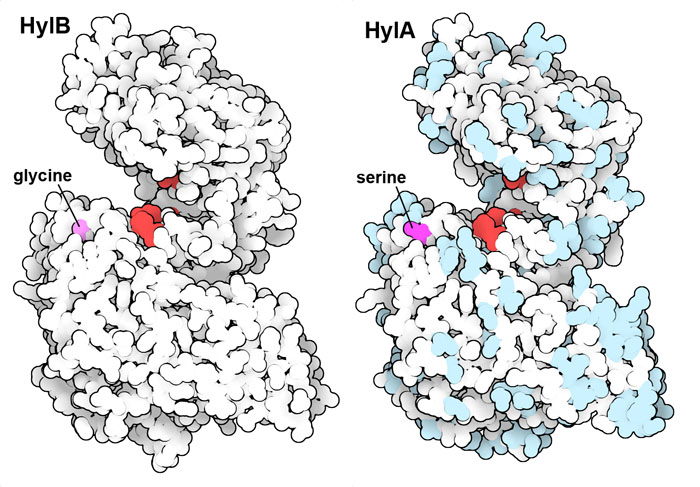 Risposta
infiammatoria Risposta
infiammatoriaI batteri contengono una serie di enzimi simili che degradano l'acido ialuronico e sono chiamati ialuronato liasi. Il nostro sistema immunitario è sempre alla ricerca di frammenti vaganti di acido ialuronico perché questi sono un segnale di infezione batterica. Per esempio, gli enzimi mostrati qui a lato appartengono al batterio Cutibacterium acnes che è responsabile della formazione dell'acne. Questi enzimi producono frammenti di acido ialuronico che inducono il nostro sistema immunitario a scatenare una risposta infiammatoria. Questa risposta, però, è molto selettiva. I ricercatori hanno scoperto che alcune varianti di questi batteri inducono l'acne, mentre altre si trovano in una pelle sana. La differenza dipende dal fatto che hanno ialuronidasi leggermente diverse, chiamate HylA e HylB, che tagliano l'acido ialuronico in modi differenti. HylA (file PDB 8fyg) taglia l'acido ialuronico in grandi frammenti che inducono l'infiammazione e causano l'acne, mentre HylB (file PDB 8fnx) produce corti frammenti di due soli zuccheri che non vengono individuati dal sistema immunitario. La sostituzione di un solo amminoacido di serina con una glicina (mostrati qui sopra in magenta) vicino al sito catalitico di HylA aumenta l'attività catalitica di HylA e produce una degradazione dell'acido ialuronico simile a quella di HylB. L'inibizione selettiva di HylA che si può ottenere con un vaccino o con un farmaco allevia i sintomi dell'acne. Nella figura sono evidenziati in rosso gli amminoacidi del sito attivo. In HylA sono mostrati in azzurro chiaro gli amminoacidi diversi da HylB, in magenta è mostrato l'amminoacido responsabile della diversa attività dei due enzimi. Esplorando la struttura Il veleno di molti animali come serpenti, ragni, scorpioni e api, spesso contiene ialuronidasi. . . . . . . . . . . 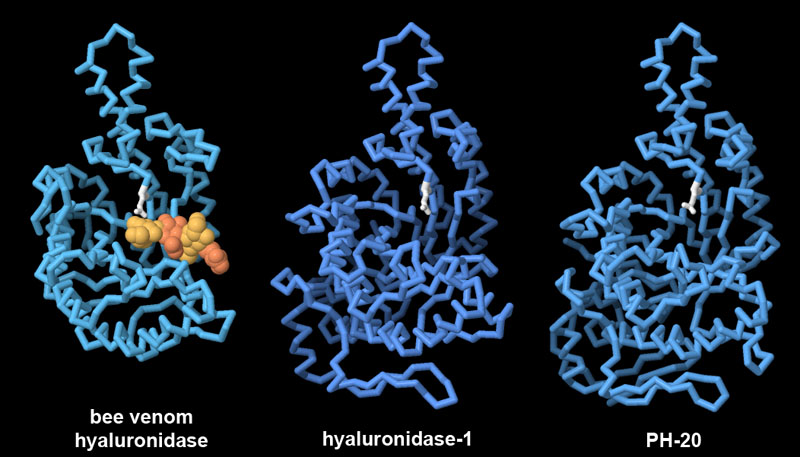 Il primo degli enzimi mostrati qui sopra (file PDB 1fcv) viene dal veleno delle api. L'enzima ialuronidasi non è tossico di per sé, ma nel veleno aiuta a degradare il tessuto connettivo attorno al pungiglione, così le molecole tossiche del veleno si possono diffondere più facilmente. Questo enzima è simile alle nostre ialuronidasi. Qui a fianco sono mostrate la ialuronidasi-1 (file PDB 2pe4) e PH-20 (model-PH20). PH-20 si trova legata alla superficie degli spermatozoi grazie ad una catena lipidica (non mostrata). Aiuta gli spermatozoi a penetrare attraverso la membrana che circonda l'ovulo e quindi aiuta la fecondazione. Nelle tre figure qui sopra l'amminoacido glutammato responsabile dell'attività catalitica è evidenziato in bianco. Spunti per ulteriori esplorazioni La struttura molecolare dell'acido ialuronico è stata determinata negli anni '70 col metodo della diffrazione da fibra, nel file PDB 2hya si vede la sua catena avvolta assieme ad atomi di sodio. Alcuni virus batteriofagi producono enzimi che tagliano l'acido ialuronico in modo insolito. Per esempio, le proteine fibrose che formano la coda del fago dello streptococco (file PDB 2c3f) hanno un'attività catalitica che taglia l'acido ialuronico. Anche le sanguisughe producono vari tipi di ialuronidasi che le aiutano ad estrarre il sangue dalle vittime (file PDB 7eyo).  Bibliografia Bibliografia8fnx, 8fyg: Hajam, I.A., Katiki, M., McNally, R., Lazaro-Diez, M., Kolar, S., Chatterjee, A., Gonzalez, C., Paulchakrabarti, M., Choudhury, B., Caldera, J.R., Desmond, T., Tsai, C.M., Du, X., Li, H., Murali, R., Liu, G.Y. (2023) Functional divergence of a bacterial enzyme promotes healthy or acneic skin. Nat Commun 14: 8061-8061 Sindelar, M., Jilkova, J., Kubala, L., Velebny, V., Turkova, K. (2021) Hyaluronidases and hyaluronate lyases: From humans to bacteriophages. Colloids Surf. B Biointerfaces 208:112095 Garantziotis, S., Savani, R. C. (2019) Hyaluronan biology: A complex balancing act of structure, function, location and context. Matrix Biol. 78-79: 1-10 2pe4: Chao, K.L., Muthukumar, L., Herzberg, O. (2007) Structure of Human Hyaluronidase-1, a Hyaluronan Hydrolyzing Enzyme Involved in Tumor Growth and Angiogenesis. Biochemistry 46: 6911-6920 1fcv: Markovic-Housley, Z., Miglierini, G., Soldatova, L., Rizkallah, P.J., Muller, U., Schirmer, T. (2000) Crystal structure of hyaluronidase, a major allergen of bee venom. Structure 8: 1025-1035
|
||||||
|
|
||||||
