|
|
Angiotensina e ipertensione |
|||||
|
Molecola del mese di ottobre 2024 Molti farmaci per controllare la pressione del sangue inibiscono l'ormone peptidico angiotensina.  Introduzione IntroduzioneLa pressione del sangue deve essere attentamente bilanciata. La pressione deve essere abbastanza alta da permettere al sangue di circolare in tutto il corpo, ma non così alta da provocare danni. Il corpo monitora costantemente la pressione del sangue e la modifica se questa esce dai valori ottimali. L'ormone angiotensina ha un ruolo centrale in questo controllo. Viene rilasciato quando la pressione deve essere aumentata. Quando l'ormone è in circolo nel nostro corpo ha diversi effetti, per esempio, provoca la costrizione dei vasi sanguigni e aumenta la sensazione di sete per indurci a bere. Mandare segnali L'angiotensina viene sintetizzata nel fegato in una forma inattiva chiamata angiotensinogeno che viene rilasciato nel flusso sanguigno quando serve. Nello stesso tempo, nei reni viene rilasciata la prorenina il precursore inattivo della renina, una piccola proteasi che ha il compito di tagliare la parte terminale dell'angiotensinogeno per liberare un decapeptide chiamato angiotensina I. Questa viene ancora accorciata da ACE (enzima che converte l'angiotensina) che rimuove altri due amminoacidi per formare l'angiotensina II, un ottapeptide. L'angiotensina II è l'ormone attivo che si lega ai recettori sulla superficie delle cellule in tutto il corpo e innesca molti processi che controllano il flusso di acqua e sali, rilasciano altri ormoni e producono vasocostrizione. Angiotensina in azione Nell'immagine qui a fianco, sono rappresentate le molecole coinvolte nel sentiero di segnalazione dell'angiotensina. La renina viene prodotta in una forma inattiva chiamata prorenina (file PDB 3vcm), mostrata più sotto. La forma attiva della renina (magenta) è mostrata in alto mentre sta tagliando l'angiotensinogeno (file PDB 2x0b). Si vede poi la proteina ACE che è un enzima legato alla membrana cellulare (fascia grigia) e possiede due domini proteolitici simili che possono tagliare oltre all'angiotensina I, anche altri ormoni peptidici. La struttura completa di ACE mostrata qui è presa dal file AF-AFP12821F1, mentre negli archivi PDB vi sono le strutture dei vari domini di ACE. Nel centro della figura si vede l'angiotensina I (file PDB 1n9u) che contiene ancora i due amminoacidi sul lato C-terminale che aspettano di essere tagliati (His-Leu) e che sono mostrati in marrone più scuro. Più sotto si vede l'angiotensina II che è priva di questi due amminoacidi (è un ottapeptide) (file PDB 1n9v). Infine si vede il recettore a cui si lega l'angiotensina II (file PDB 6os0) e che la contiene al suo interno. Qui sotto è mostrata l'angiotensina I usando Chimera. I due amminoacidi che devono essere tagliati sono evidenziati in marrone. .. . 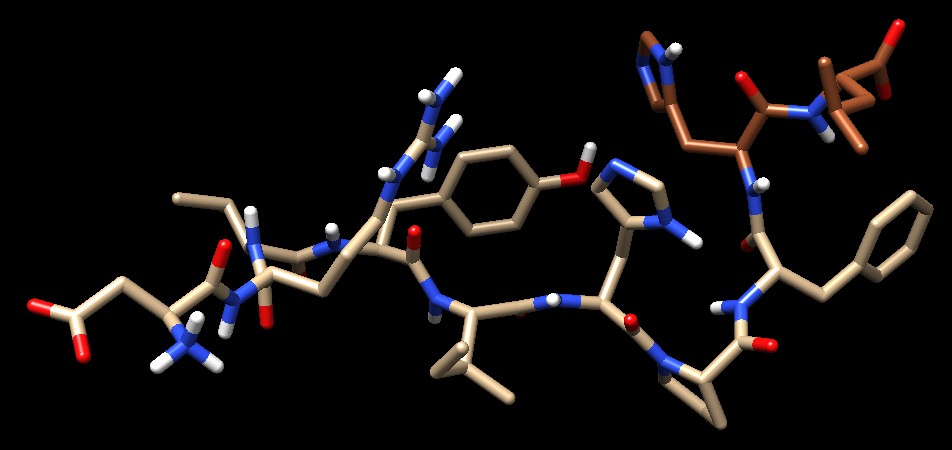  Farmaci
anti ipertensione Farmaci
anti ipertensioneLa comprensione della struttura delle proteine coinvolte nel sentiero di segnalazione della angiotensina ha permesso ai ricercatori di sviluppare farmaci che ne modificano l'azione per abbassare la pressione quando è necessario. Uno dei farmaci più usati è lisinopril mostrato qui in giallo. Questo farmaco agisce legandosi al sito attivo di ACE (file PDB 1o86) e così impedisce all'enzima di produrre la forma attiva dell'angiotensina. Dato che il controllo dell'ipertensione è molto importante per la salute, sono stati sviluppati anche altri farmaci che bloccano il sentiero di segnalazione in punti diversi. Per esempio, nel prossimo paragrafo, è mostrato Aliskiren, un farmaco che blocca l'azione della renina.  Esplorando
la struttura Esplorando
la strutturaRenina in azione Le tre immagini qui a lato mostrano tre diversi stati in cui si può trovare l'enzima proteolitico renina durante la sua azione. Nella prima immagine si vede la prorenina (file PDB 3vcm), la forma inattiva della renina che viene prodotta nei reni. Subito dopo la sintesi, da questa proteina viene tagliato un frammento chiamato propeptide (viola) che ostruisce il sito attivo della proteina e così si libera l'enzima attivo. La renina attiva è conservata all'interno di vescicole pronte a rilasciarla quando serve. Nella seconda immagine si vede la renina legata all'angiotensinogeno (giallo) (file PDB 2x0b). La renina fa entrare nel proprio sito attivo solo quel tratto della catena che deve essere tagliato. Nella terza immagine si vede il farmaco Aliskiren (verde) legato in profondità nel sito attivo dell'enzima (file PDB 2v0z). In questo modo il farmaco impedisce alla renina di svolgere la sua funzione e aiuta a ridurre la pressione sanguigna. Spunti per ulteriori esplorazioni L'enzima ACE2 è simile all'enzima ACE descritto più sopra. ACE2 fa ulteriori tagli all'angiotensina, ma è anche usato dal virus SARS-COV-2 come recettore per l'infezione. Potete esplorarne la struttura nel file PDB 6m17. Potete confrontare i due enzimi ACE e ACE2 usando, nel sito PDB, lo strumento Pairwise Structure Alignment con i due file PDB 1o86 e 2c6n. Fountain, J. H., Kaur, J., Lappin, S. L. (2024) Physiology, Renin Angiotensin System. StatPearls www.ncbi.nlm.nih.gov/books/NBK470410/ 6os0: Wingler, L.M., Skiba, M.A., McMahon, C., Staus, D.P., Kleinhenz, A.L.W., Suomivuori, C.M., Latorraca, N.R., Dror, R.O., Lefkowitz, R.J., Kruse, A.C. (2020) Angiotensin and biased analogs induce structurally distinct active conformations within a GPCR. Science 367: 888-892 Bernstein, K.E., Ong, F.S., Blackwell, W.L.B., Shah, K.H., Giani, J.F., Gonzalez-Villalobos, R.A., Shen, X.Z., Fuchs, S. (2013) A modern understanding of the traditional and nontraditional biological functions of angiotensin-converting enzyme. Pharmacol Rev 65: 1-46 2x0b: Zhou, A., Carrell, R.W., Murphy, M.P., Wei, Z., Yan, Y., Stanley, P.L., Stein, P.E., Pipkin, F.B., Read, R.J.(2010) A redox switch in angiotensinogen modulates angiotensin release. Nature 468: 108 1o86: Natesh, R., Schwager, S.L.U., Sturrock, E.D., Acharya, K.R. (2003) Crystal structure of the human angiotensin-converting enzyme-lisinopril complex. Nature 421: 551 1n9u: Spyroulias, G.A., Nikolakopoulou, P., Tzakos, A., Gerothanassis, I.P., Magafa, V., Manessi-Zoupa, E., Cordopatis, P. (2003) Comparison of the solution structures of angiotensin I & II. Implication for structure-function relationship. Eur J Biochem 270: 2163-2173 2v0z: Rahuel, J., Rasetti, V., Maibaum, J., Rueger, H., Goschke, R., Cohen, N.C., Stutz, S., Cumin, F., Fuhrer, W., Wood, J.M., Grutter, M.G. (2000) Structure-based drug design: The discovery of novel nonpeptide orally active inhibitors of human renin. Chem Biol 7: 493-504
|
||||||
|
|
||||||
