|
Molecola del mese di febbraio 2004
I dieci enzimi della glicolisi rompono
il glucosio che introduciamo con il cibo per produrre energia
 Introduzione Introduzione
Il glucosio dà energia a tutte le nostre cellule.
E' una molecola combustibile conveniente perché è stabile
e solubile, quindi è facile da trasportare attraverso il sangue.
Il glucosio viene immagazzinato nel fegato sotto forma di glicogeno
e da qui viene trasportato in tutte le cellule che lo possono utilizzare
rapidamente per ricavarne energia. Se il glucosio viene bruciato in una
provetta forma anidride carbonica, acqua, luce e calore. Anche le nostre
cellule bruciano glucosio, ma lo fanno in una serie di tappe piccole e
ben controllate, così possono catturare l'energia della reazione
in una forma più facilmente utilizzabile, ATP. La glicolisi (scissione
dello zucchero) è il primo processo nella combustione cellulare
del glucosio.
Scissione del glucosio
La glicolisi (si pronuncia glicòlisi) sottopone
una molecola di glucosio ad una serie di dieci trasformazioni chimiche
in sequenza che alla fine producono due molecole di acido piruvico,
due ATP e due NADH secondo la seguente reazione (semplificata):

Durante questo processo, il glucosio dapprima
viene legato a due fosfati (consumando due ATP), poi è tagliato
in due frammenti di tre atomi di carbonio, e infine isomerizzato e disidratato.
Si ottengono così due molecole di acido piruvico e vengono liberati
quattro ATP. In totale, quindi, la glicolisi produce due ATP (4-2) usando
l'energia della demolizione parziale del glucosio ad acido piruvico.
L'ATP viene usato per dare energia ai processi molecolari in tutta la
cellula. Inoltre, la reazione 6 della glicolisi, ossidando la gliceraldeide-3-fosfato,
produce due NADH, che possono essere usati per riduzioni biochimiche
o per creare nuova energia chimica.
Dopo la glicolisi
Il sesto enzima della glicolisi rimuove uno ione
idruro dalla gliceraldeide-3-fosfato, trasferendolo al NAD+
(nicotinamide adenina dinucleotide) che viene ridotto a NADH. Se la
cellula non mettesse in moto altre reazioni in grado di riconvertire
il NADH in NAD+,
questo sarebbe subito esaurito e la glicolisi si fermerebbe.
Le cellule hanno sviluppato modi diversi per ossidare nuovamente il
NADH in NAD+:
1) Respirazione cellulare. Molte cellule, inclusa la maggior
parte delle nostre, ossidano il NADH a NAD+
con l'ossigeno molecolare O2,
producendo così molto ATP attraverso una serie di reazioni chiamate
catena
respiratoria (mdm 12-2011) e fosforilazione
ossidativa (mdm 12-2005).
2) Fermentazione alcolica. Le cellule di
lievito che vivono in assenza di ossigeno, usano l'acido piruvico prodotto
dalla glicolisi come molecola ossidante. Prima fanno perdere CO2
all'acido piruvico formando acetaldeide, poi questa per mezzo
dell'enzima alcol
deidrogenasi (mdm 1-2001) ossida il NADH a NAD+
formando alcol etilico che è espulso dalla cellula. Ogni
volta che beviamo birra o vino, assumiamo alcol prodotto attraverso
questo processo.
3) Fermentazione lattica. I muscoli sotto sforzo intenso non
riescono ad ottenere dal sangue abbastanza ossigeno per sostenere la
loro azione, quindi al posto dell'ossigeno, usano come molecola ossidante
l'acido piruvico prodotto dalla glicolisi. Per mezzo dell'enzima lattato
deidrogenasi (mdm 6-2008) ossidano il NADH a NAD+
usando l'acido piruvico che viene ridotto ad
acido lattico. Durante un'intensa attività anaerobica, l'acido
lattico si accumula nei muscoli, e quando raggiunge livelli elevati,
li obbliga a fermarsi per riposare e riconvertire l'acido lattico in
glucosio.
I magnifici dieci
La glicolisi è un processo semplice e geniale
che si realizza in dieci tappe governate da dieci enzimi diversi
Questi si sono perfezionati nel corso dell'evoluzione per realizzare
con efficienza i loro compiti chimici: aggiungere, rimuovere o spostare
atomi senza commettere errori. Il processo è attentamente regolato,
così il glucosio viene degradato solamente quando c'è
bisogno di energia. Nella glicolisi, si trovano esempi di enzimi allosterici
che cambiano forma durante il loro funzionamento; enzimi che formano
legami covalenti con i loro substrati; ed enzimi che usano ioni metallici
o molecole organiche per completare la propria azione. Alcuni di questi
enzimi sono così efficienti che lavorano più velocemente
del ritmo con il quale le molecole di zucchero possono arrivare a loro.
L'intero processo è sottoposto a regolazione enzimatica così
che ogni passo procede facilmente, ma in modo controllato, verso l'obiettivo
di catturare quanta più energia possibile dalla demolizione ossidativa
del glucosio.
1) Esochinasi

La esochinasi compie il primo passo della glicolisi, usando una molecola
di ATP per avviare il processo. Trasferisce un gruppo fosfato dall'ATP
al glucosio, formando glucosio-6-fosfato. La esochinasi ha la forma
di un morsetto, con un grande incavo su un lato e svolge la sua azione
compiendo un movimento di adattamento indotto, chiudendosi intorno
al glucosio dopo che questo si è legato nel sito attivo.
La struttura senza glucosio, mostrata qui sotto sulla sinistra (file
PDB 1ig8) è aperta
e permette al glucosio di entrare nel sito attivo. Non contiene ATP,
ma solo un gruppo solfato che si trova dove si lega l'ultimo fosfato
di ATP.
Quando il glucosio (carboni verdi e ossigeni rossi) entra nel sito attivo,
come mostrato qui sotto sulla destra (file PDB 1hkg)
la struttura si chiude e lo avvolge allontanando le molecole d'acqua
per facilitare la reazione con ATP.

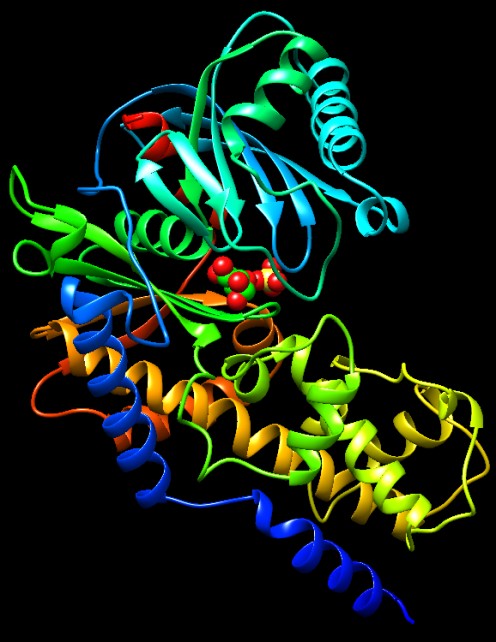
 Come
accade spesso, le cose diventano più complicate quando si considera
il modello umano. Nell'uomo vi sono molti tipi di esochinasi, per soddisfare
le necessità lievemente diverse di vari tipi di cellule. L'enzima
illustrato qui a destra è preso da cellule di cervello (file
PDB 1dgk). È due
volte più grande della esochinasi di lievito, ma la cosa straordinaria
è che è costruito da due subunità che assomigliano
a due enzimi di lievito legati testa-a-coda. Le due metà hanno
un sito attivo quasi identico. Quella inferiore è realizza
la reazione catalitica. Come
accade spesso, le cose diventano più complicate quando si considera
il modello umano. Nell'uomo vi sono molti tipi di esochinasi, per soddisfare
le necessità lievemente diverse di vari tipi di cellule. L'enzima
illustrato qui a destra è preso da cellule di cervello (file
PDB 1dgk). È due
volte più grande della esochinasi di lievito, ma la cosa straordinaria
è che è costruito da due subunità che assomigliano
a due enzimi di lievito legati testa-a-coda. Le due metà hanno
un sito attivo quasi identico. Quella inferiore è realizza
la reazione catalitica.
Quella superiore è specializzata nella regolazione
e non sa compiere la reazione di trasferimento del fosfato.
2) Fosfoglucosio isomerasi
 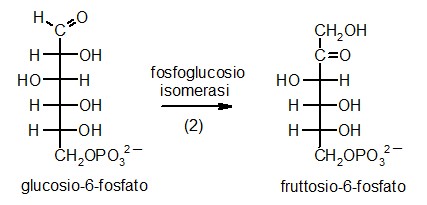
La seconda tappa della glicolisi è una
isomerizzazione: una reazione che cambia la struttura di una molecola,
senza aggiungere o rimuovere atomi. L'enzima fosfoglucosio isomerasi,
mostrato qui a fianco (file PDB 1hox)
prende il glucosio-6-fosfato e cambia di posto alcuni atomi, formando
fruttosio-6-fosfato (mostrato in giallo). L'enzima può far procedere
questa reazione in entrambe le direzioni. Quindi, quando il glucosio-6-fosfato
è abbondante nella cellula, viene convertito in fruttosio-6-fosfato,
mentre quando vi è più fruttosio-6-fosfato, l'enzima compie
la reazione inversa e lo converte in glucosio-6-fosfato.
I ricercatori hanno scoperto da poco che questa proteina svolge anche
altri ruoli fuori dalla cellula, dove non si comporta come un enzima,
ma piuttosto come un messaggero molecolare. Viene prodotto dai globuli
bianchi del sangue e contribuisce al controllo della crescita e del movimento
di molti tipi di cellule. Indagando sempre più in profondità
nel genoma umano, i ricercatori continuano a scoprire numerosi esempi
di proteine dalla doppia personalità che hanno una funzione in
un luogo nel corpo ed una funzione completamente diversa da qualche altra
parte come la aconitasi
(mdm 5-2007) del ciclo di Krebs.
3) Fosfofruttochinasi
 
La terza tappa costituisce il punto principale
di regolazione della glicolisi.
Il glucosio-6-fosfato e il fruttosio-6-fosfato, formati nelle prime due
tappe della glicolisi, possono essere usati anche da altri processi cellulari.
Ma quando la fosfofruttochinasi aggiunge un secondo fosfato allo zucchero,
questo è destinato ad essere spezzato in frammenti. La fosfofruttochinasi
è come un piccolo computer molecolare che sente i livelli di molecole
diverse e decide se è il momento giusto per rompere lo zucchero.
Per esempio, quando sono alti i livelli di ADP ed AMP, la cellula ha bisogno
di sintetizzare ATP, e così l'enzima si attiva. L'enzima batterico
mostrato sulla destra (file PDB 4pfk)
è composto di quattro subunità identiche. Gli enzimi presenti
nelle cellule umane sono anche più grandi e più complessi.
Il sito attivo lega lo zucchero (giallo) ed un ATP (rosso, in realtà
in questa struttura è legato ADP, insieme ad un ione magnesio,
verde). Notate che i due siti di legame per lo zucchero sono composti
da due subunità diverse, che si avvicinano ad entrambi i lati della
molecola. L'enzima ha anche siti di legame regolatori sia in alto che
in basso. In questi sono legate altre molecole di ADP, segnate con asterischi.
La fosfofruttochinasi realizza la sua azione grazie al fatto che le sue
subunità sono mobili.
Come è mostrato qui sotto, in una vista di lato della molecola,
tutto l'enzima si deforma quando l'ADP si lega ai siti regolatori. La
forma attiva dell'enzima è mostrata sulla sinistra (file PDB 4pfk)
mentre quella inattiva è mostrata a destra (file PDB 6pfk).
Quando l'enzima si flette (come indicato dalle frecce), la forma del sito
attivo cambia e l'enzima attivo diventa inattivo.
. . . . . . . . . . . . .
. . . . . . 
4) Fruttosio-1,6-bisfosfato aldolasi
 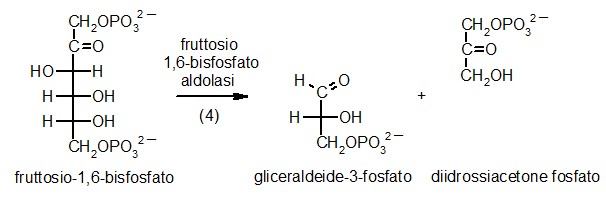
A questo punto della glicolisi, la molecola di zucchero
è attivata e la cellula è pronta per tagliarla. Il quarto
enzima, fruttosio-1,6-bisfosfato aldolasi, taglia la molecola nel mezzo,
producendo due pezzi simili, ognuno con un solo fosfato legato. L'enzima
può realizzare anche la reazione inversa, legando insieme queste
due molecole più piccole per riformare il fruttosio-1,6-bisfosfato.
Anzi, l'enzima prende il nome da questa reazione inversa che è
una condensazione aldolica. L'enzima mostrato qui (file PDB 4ald)
si trova nelle nostre cellule muscolari. Contiene quattro subunità
identiche, ognuna col suo proprio sito attivo.
Il sito attivo usa una speciale lisina (Lys 229) per attaccare la catena
del fruttosio. Come mostrato qui sotto (file PDB 1j4e)
questa lisina forma un legame covalente con il carbonile del
fruttosio durante la reazione di scissione. Questa struttura è
congelata in uno stadio in cui la molecola di fruttosio è stato
tagliata liberando gliceraldeide e lasciando solo diidrossiacetone
fosfato (con i tre carboni verdi) legato alla lisina nel sito attivo.
Il sito attivo è inserito in una particolare struttura cilindrica
a "barile beta" caratteristica anche di altri enzimi
della glicolisi.
. . . . . . . . . . . . . . . 
L'enzima aldolasi usato dalla maggior parte dei batteri è diverso
dall'aldolasi che abbiamo nelle nostre cellule. Usa due ioni zinco invece
di un amminoacido lisina. Potete vedere un esempio di una aldolasi batterica
nel file PDB 1zen.
Infine date un'occhiata allo strano enzima prodotto dagli archeobactteri
delle sorgenti calde (file PDB 1ojx)
che usa una lisina nel sito attivo, come il nostro enzima, ma è
composto di dieci catene che formano un complesso molecolare enorme.
5) Triosofosfato isomerasi
 
A questo punto della glicolisi, la cellula ha rotto
lo zucchero in due frammenti diversi. Per economia, l'ideale sarebbe
procedere lungo un solo sentiero, invece che lungo percorsi separati
per ognuno dei due pezzi. La quinta tappa della glicolisi rende questo
possibile interconvertendo i due pezzi uno nell'altro. La trioso fosfato
isomerasi, mostrata qui a destra (file PDB 2ypi)
strappa un H+
ad un atomo di carbonio e lo sostituisce su un atomo di carbonio vicino.
Un particolare amminoacido di acido glutammico (Glu 165) compie il trasferimento.
La trioso fosfato isomerasi compie il suo lavoro miliardi di volte più
velocemente della reazione non catalizzata. È così veloce
che la velocità di reazione è determinata da quanto velocemente
le molecole possono arrivare all'enzima .
Il sito attivo è mostrato in dettaglio nella figura qui sotto,
notate che è inserito in un "barile beta" una
struttura di forma cilindrica di catene beta (gialle) circondata da
un anello esterno di alfa eliche (rosse) simile a quello della reazione
precedente di aldolasi. Notate che ogni alfa elica connette la testa
di una catena beta con la coda di quella vicina.
. . . . . . . . . . . 
6) Gliceraldeide-3-fosfato deidrogenasi
 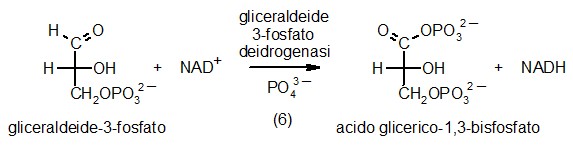
Ora che la glicolisi ha spezzato il glucosio in due frammenti uguali
di gliceraldeide-3-fosfato, si può finalmente cercare di ricavarne
energia. Per raggiunge questo scopo, la cellula sfrutta il fatto che
le aldeidi sono molto facilmente ossidabili ad acidi. Per ossidare la
gliceraldeide-3-fosfato ad acido 3-fosfoglicerico utilizza un ossidante
più forte del necessario, il NAD+,
(magenta) che prende su di sè uno ione idruro (idrogeno negativo)
diventando NADH. La cosa notevole è che l'eccesso di energia
liberato in questa reazione non va perduto, ma viene recuperato legando
all'acido glicerico uno ione fosfato inorganico che poi, nella tappa
numero 7, verrà trasferito all'ADP per sintetizzare ATP.
Il NADH che si forma può essere usato o per creare altra energia
reagendo con O2
(respirazione cellulare) o per ridurre gli stessi frammenti della molecola
di glucosio prodotti dalla glicolisi (fermentazione). In tutti e due
i casi si ottiene un risultato importante anche dal punto di vista chimico:
il NADH torna nella sua forma ossidata NAD+
e diventa ancora capace di ossidare la gliceraldeide 3-fosfato nella
tappa numero 6.
 La
gliceraldeide-3-fosfato deidrogenasi è composta da quattro subunità
identiche. Molte delle strutture di questo enzima, come la forma umana
illustrata qui sopra (file PDB 3gpd)
hanno il NAD+
legato in tutti e quattro i siti attivi, insieme con due ioni fosfato.
Un ione è legato nel sito che dovrebbe ospitare il gruppo fosfato
appartenente alla molecola di zucchero, e si pensa che l'altro sia legato
nel sito che posiziona lo ione fosfato inorganico entrante per la reazione. La
gliceraldeide-3-fosfato deidrogenasi è composta da quattro subunità
identiche. Molte delle strutture di questo enzima, come la forma umana
illustrata qui sopra (file PDB 3gpd)
hanno il NAD+
legato in tutti e quattro i siti attivi, insieme con due ioni fosfato.
Un ione è legato nel sito che dovrebbe ospitare il gruppo fosfato
appartenente alla molecola di zucchero, e si pensa che l'altro sia legato
nel sito che posiziona lo ione fosfato inorganico entrante per la reazione.
La figura qui a fianco (file PDB 1nqo)
mostra la prima parte della reazione, quando la molecola di substrato
si è appena legata. Un amminoacido cisteina (sostituita
qui con una serina meno reattiva) attacca poi la molecola, formando
un legame con il carbonio aldeidico. Questo carbonio viene poi ossidato
dal NAD+ formando
un tioestere molto reattivo che in seguito si rompe reagendo con uno
ione fosfato inorganico (non mostrato). Un'istidina lì vicino
assiste la reazione.
7) Fosfoglicerato chinasi

 Ora,
nella settima tappa della glicolisi, la cellula è pronta a sintetizzare
ATP. Per ogni glucosio degradato abbiamo ottenuto due molecole di acido
glicerico 1,3-bisfosfato. La fosfoglicerato chinasi prende queste molecole
e trasferisce all'ADP il fosfato presente sul carbossile, formando una
molecola di ATP. Come col primo enzima della glicolisi, questo processo
deve avvenire lontano dall'acqua per assicurare che il fosfato sia trasferito
correttamente. La fosfoglicerato chinasi usa lo stesso approccio utilizzato
dalla esochinasi: fa avvenire la reazione in uno spazio chiuso situato
all'interno dell'enzima, al riparo dalle molecole di acqua che potrebbero
interferire. L'enzima è composto di due lobi uniti da un collegamento
flessibile. Il lobo superiore si lega all'ADP mentre quello inferiore
ha una tasca per l'acido glicerico 1,3-bisfosfato. L'enzima poi si chiude
strettamente e compie il trasferimento del fosfato. La struttura mostrata
qui a lato sulla sinistra (file PDB 3pgk)
è nella forma aperta con l'ADP legato, mentre la struttura mostrata
sulla destra (file PDB 1vpe)
è nella forma chiusa. Ora,
nella settima tappa della glicolisi, la cellula è pronta a sintetizzare
ATP. Per ogni glucosio degradato abbiamo ottenuto due molecole di acido
glicerico 1,3-bisfosfato. La fosfoglicerato chinasi prende queste molecole
e trasferisce all'ADP il fosfato presente sul carbossile, formando una
molecola di ATP. Come col primo enzima della glicolisi, questo processo
deve avvenire lontano dall'acqua per assicurare che il fosfato sia trasferito
correttamente. La fosfoglicerato chinasi usa lo stesso approccio utilizzato
dalla esochinasi: fa avvenire la reazione in uno spazio chiuso situato
all'interno dell'enzima, al riparo dalle molecole di acqua che potrebbero
interferire. L'enzima è composto di due lobi uniti da un collegamento
flessibile. Il lobo superiore si lega all'ADP mentre quello inferiore
ha una tasca per l'acido glicerico 1,3-bisfosfato. L'enzima poi si chiude
strettamente e compie il trasferimento del fosfato. La struttura mostrata
qui a lato sulla sinistra (file PDB 3pgk)
è nella forma aperta con l'ADP legato, mentre la struttura mostrata
sulla destra (file PDB 1vpe)
è nella forma chiusa.
8) Fosfoglicerato mutasi
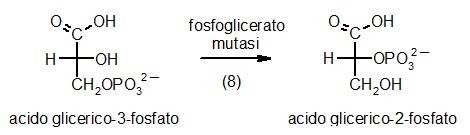
 Il
guadagno di ATP nelle prime 7 tappe della glicolisi è stato zero.
Infatti, nelle tappe 1 e 3 si sono consumati 2 ATP e nella tappa numero
7 si sono guadagnati 2 ATP. Nelle tre tappe che restano per concludere
il processo è indispensabile produrre altri ATP altrimenti tutta
la glicolisi perde di significato. Il
guadagno di ATP nelle prime 7 tappe della glicolisi è stato zero.
Infatti, nelle tappe 1 e 3 si sono consumati 2 ATP e nella tappa numero
7 si sono guadagnati 2 ATP. Nelle tre tappe che restano per concludere
il processo è indispensabile produrre altri ATP altrimenti tutta
la glicolisi perde di significato.
In effetti nelle utime tre tappe si producono 2 ATP trasferendo all'ADP
il fosfato rimasto sull'acido 3-fosfoglicerico. Questa reazione però
non può essere realizzata in modo diretto perchè l'energia
ottenuta dalla semplice idrolisi di un estere fosforico non è
sufficiente a produrre una molecola ricca di energia come l'ATP. La
strategia quindi è quella di creare nella molecola una situazione
di instabilità, l'enolo dell'acido fosfoenolpiruvico che trasformandosi
nella forma chetonica più stabile darà la spinta decisiva
per sintetizzare ATP nella tappa 10.
 La
fosfoglicerato mutasi realizza la prima delle trasformazioni necessarie
per produrre ATP: sposta il fosfato dal carbonio 3 al carbonio 2 in
modo da liberare l'OH sul carbonio 3 per avere un beta idrossi acido
che al prossimo passaggio può disidratarsi formando un acido
alfa, beta insaturo. La
fosfoglicerato mutasi realizza la prima delle trasformazioni necessarie
per produrre ATP: sposta il fosfato dal carbonio 3 al carbonio 2 in
modo da liberare l'OH sul carbonio 3 per avere un beta idrossi acido
che al prossimo passaggio può disidratarsi formando un acido
alfa, beta insaturo.
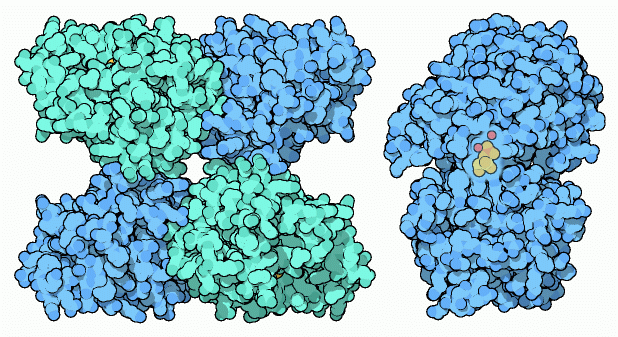
Questo enzima esiste in molte forme: l'enzima
del lievito, mostrato in alto a sinistra. (file PDB 3pgk)
è composto di quattro subunità identiche. L'enzima umano
è simile, ma contiene solamente due subunià. Le piante
e molti batteri costruiscono un enzima completamente diverso che usa
ioni manganese per la reazione, come mostrato qui sopra a destra (file
PDB 1eqj)
L'enzima nelle nostre cellule usa un amminoacido istidina speciale,
come quello mostrato qui a destra in un enzima batterico (file PDB 1e58).
Questa istidina estrae il fosfato e lo mette in un luogo diverso nella
molecola. In realtà, l'enzima compie queste operazioni alla rovescia:
prima mette un fosfato nella molecola che, per qualche istante, ne ha
due legati, poi stacca l'altro. Per fare questo l'enzima deve essere
caricato con un'altra molecola di fosfato prima di compiere la sua reazione.
Una piccola molecola intermedia l'acido 2,3-difosfoglicerico porta questi
fosfati reattivi all'enzima. Dopo che l'enzima si è caricato,
rimane attivo per uno o due minuti compiendo senza sosta la sua reazione
molte volte prima che il fosfato venga perduto e debba essere sostituito.
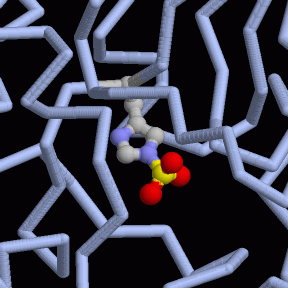
9) Enolasi
 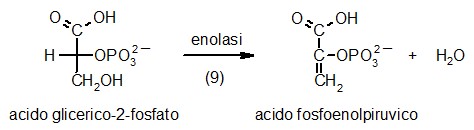
Nella tappa 9 della glicolisi, l'enzima enolasi
disidrata l'acido 2-fosfoglicerico per formare l'acido fosfoenolpiruvico.
Questo è un enolo, una molecola instabile che nella tappa 10
verrà trasformato in un chetone, più stabile, cedendo
il fosfato per formare ATP. Il compito dell'enzima enolasi è
relativamente semplice, infatti l'eliminazione di una molecola di acqua
dall'acido 2-fosfoglicerico, forma un nuovo doppio legame in posizione
coniugata con il carbossile della molecola.
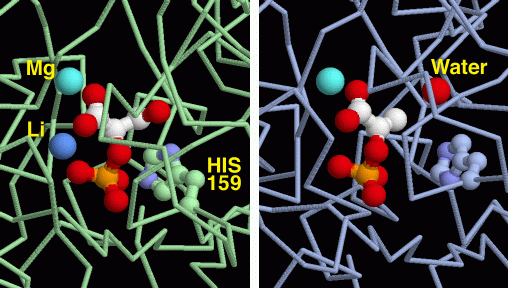
L'enzima enolasi mostrato qui a destra (file PDB 2one)
è interessante perchè mostra due fasi di questa reazione,
prima e dopo che l'acqua è stata rimossa. L'enzima contiene due
siti attivi identici. La struttura cristallina ha congelato uno stato
diverso in ognuno dei siti attivi.
L'immagine di sinistra mostra la molecola prima che la reazione inizi,
mentre quella di destra mostra la molecola dopo che l'acqua è
stata rimossa. L'enolasi usa due ioni metallici in questa reazione.
Il primo è un ione magnesio (azzurro) che lega la molecola all'enzima,
e la tiene nella giusta posizione. Il secondo è uno ione litio
(blu) che lega la molecola e aiuta la catalisi. Un'istidina (His) si
trova nella posizione ideale per catalizzare la reazione.
. . . . . . . . . . . . . . . .
. . . . . . . . 
10) Piruvato chinasi
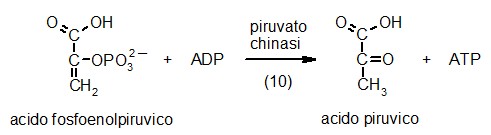
 Nell'ultima
tappa della glicolisi, la cellula finalmente è pronta a realizzare
il guadagno netto di ATP. L'enzima piruvato chinasi rimuove il gruppo
fosfato dal carbonio 2 dell'acido fosfoenolpiruvico e lo trasferisce
all'ADP formando ATP. L'energia per la sintesi di ATP viene dalla reazione
che trasforma l'enolo instabile dell'acido fosfoenolpiruvico, nel corrispondente
chetone stabile formando acido piruvico. Come abbiamo visto in precedenza,
l'acido piruvuco è il prodotto finale della glicolisi e può
subire due destini diversi: Nell'ultima
tappa della glicolisi, la cellula finalmente è pronta a realizzare
il guadagno netto di ATP. L'enzima piruvato chinasi rimuove il gruppo
fosfato dal carbonio 2 dell'acido fosfoenolpiruvico e lo trasferisce
all'ADP formando ATP. L'energia per la sintesi di ATP viene dalla reazione
che trasforma l'enolo instabile dell'acido fosfoenolpiruvico, nel corrispondente
chetone stabile formando acido piruvico. Come abbiamo visto in precedenza,
l'acido piruvuco è il prodotto finale della glicolisi e può
subire due destini diversi:
Nella respirazione cellulare viene completamente osidato con O2
formando acqua e CO2
Nella fermentazione alcolica viene prima decarbossilato formando CO2
e poi ridotto ad etanolo.
Nella fermentazione lattica viene ridotto ad acido lattico.
La reazione finale della glicolisi è regolata dall'enzima piruvato
chinasi, questo assicura che l'ATP venga sintetizzato solamente quando
ce n'è bisogno. Come l'emoglobina, questo enzima viene attivato
progressivamente all'aumentare dei livelli del suo materiale di partenza.
È attivato anche dalla presenza di zuccheri fosforilati che indicano
che molte materie prime sono disponibili. Al contrario, è inibito
da molecole che sono abbondanti quando la cellula ha abbastanza energia,
come ATP e amminoacidi. La piruvato chinasi è un grosso enzima
allosterico che sente i livelli di tutte queste molecole e cambia
forma a seconda della loro presenza. È composto di quattro subunità
flessibili sistemate a forma di stella. L'intero complesso si piega
quando si legano molecole nei siti di regolazione. Nelle due strutture
mostrate qui sopra, i siti catalitici si trovano in alto e in basso,
mentre i siti regolatori si trovano a sinistra e a destra.
La struttura batterica mostrata sulla sinistra (file PDB 1e0u)
si trova nella forma inattiva, più stretta.
La struttura di lievito sulla destra, dall'archivio PDB 1a3w,
si trova nella forma attiva dato che possiede molecole di fruttosio
1,6-bisfosfato (magenta) legate nei siti regolatori. I siti attivi contengono
un analogo dell'acido fosfoenolpiruvico (giallo) e due ioni metallici,
uno ione potassio ed uno ione manganese (verdi) che aiutano la reazione.
|
|
|
 Introduzione
Introduzione


















 La
gliceraldeide-3-fosfato deidrogenasi è composta da quattro subunità
identiche. Molte delle strutture di questo enzima, come la forma umana
illustrata qui sopra (file PDB
La
gliceraldeide-3-fosfato deidrogenasi è composta da quattro subunità
identiche. Molte delle strutture di questo enzima, come la forma umana
illustrata qui sopra (file PDB 
 Ora,
nella settima tappa della glicolisi, la cellula è pronta a sintetizzare
ATP. Per ogni glucosio degradato abbiamo ottenuto due molecole di acido
glicerico 1,3-bisfosfato. La fosfoglicerato chinasi prende queste molecole
e trasferisce all'ADP il fosfato presente sul carbossile, formando una
molecola di ATP. Come col primo enzima della glicolisi, questo processo
deve avvenire lontano dall'acqua per assicurare che il fosfato sia trasferito
correttamente. La fosfoglicerato chinasi usa lo stesso approccio utilizzato
dalla esochinasi: fa avvenire la reazione in uno spazio chiuso situato
all'interno dell'enzima, al riparo dalle molecole di acqua che potrebbero
interferire. L'enzima è composto di due lobi uniti da un collegamento
flessibile. Il lobo superiore si lega all'ADP mentre quello inferiore
ha una tasca per l'acido glicerico 1,3-bisfosfato. L'enzima poi si chiude
strettamente e compie il trasferimento del fosfato. La struttura mostrata
qui a lato sulla sinistra (file PDB
Ora,
nella settima tappa della glicolisi, la cellula è pronta a sintetizzare
ATP. Per ogni glucosio degradato abbiamo ottenuto due molecole di acido
glicerico 1,3-bisfosfato. La fosfoglicerato chinasi prende queste molecole
e trasferisce all'ADP il fosfato presente sul carbossile, formando una
molecola di ATP. Come col primo enzima della glicolisi, questo processo
deve avvenire lontano dall'acqua per assicurare che il fosfato sia trasferito
correttamente. La fosfoglicerato chinasi usa lo stesso approccio utilizzato
dalla esochinasi: fa avvenire la reazione in uno spazio chiuso situato
all'interno dell'enzima, al riparo dalle molecole di acqua che potrebbero
interferire. L'enzima è composto di due lobi uniti da un collegamento
flessibile. Il lobo superiore si lega all'ADP mentre quello inferiore
ha una tasca per l'acido glicerico 1,3-bisfosfato. L'enzima poi si chiude
strettamente e compie il trasferimento del fosfato. La struttura mostrata
qui a lato sulla sinistra (file PDB 
 Il
guadagno di ATP nelle prime 7 tappe della glicolisi è stato zero.
Infatti, nelle tappe 1 e 3 si sono consumati 2 ATP e nella tappa numero
7 si sono guadagnati 2 ATP. Nelle tre tappe che restano per concludere
il processo è indispensabile produrre altri ATP altrimenti tutta
la glicolisi perde di significato.
Il
guadagno di ATP nelle prime 7 tappe della glicolisi è stato zero.
Infatti, nelle tappe 1 e 3 si sono consumati 2 ATP e nella tappa numero
7 si sono guadagnati 2 ATP. Nelle tre tappe che restano per concludere
il processo è indispensabile produrre altri ATP altrimenti tutta
la glicolisi perde di significato.




 Nell'ultima
tappa della glicolisi, la cellula finalmente è pronta a realizzare
il guadagno netto di ATP. L'enzima piruvato chinasi rimuove il gruppo
fosfato dal carbonio 2 dell'acido fosfoenolpiruvico e lo trasferisce
all'ADP formando ATP. L'energia per la sintesi di ATP viene dalla reazione
che trasforma l'enolo instabile dell'acido fosfoenolpiruvico, nel corrispondente
chetone stabile formando acido piruvico. Come abbiamo visto in precedenza,
l'acido piruvuco è il prodotto finale della glicolisi e può
subire due destini diversi:
Nell'ultima
tappa della glicolisi, la cellula finalmente è pronta a realizzare
il guadagno netto di ATP. L'enzima piruvato chinasi rimuove il gruppo
fosfato dal carbonio 2 dell'acido fosfoenolpiruvico e lo trasferisce
all'ADP formando ATP. L'energia per la sintesi di ATP viene dalla reazione
che trasforma l'enolo instabile dell'acido fosfoenolpiruvico, nel corrispondente
chetone stabile formando acido piruvico. Come abbiamo visto in precedenza,
l'acido piruvuco è il prodotto finale della glicolisi e può
subire due destini diversi: