|
|
Tossina del colera |
|||||
|
Molecola del mese di settembre 2005 Molte tossine batteriche sono composte di due parti, una che si lega alla cellula bersaglio, l'altra che la uccide 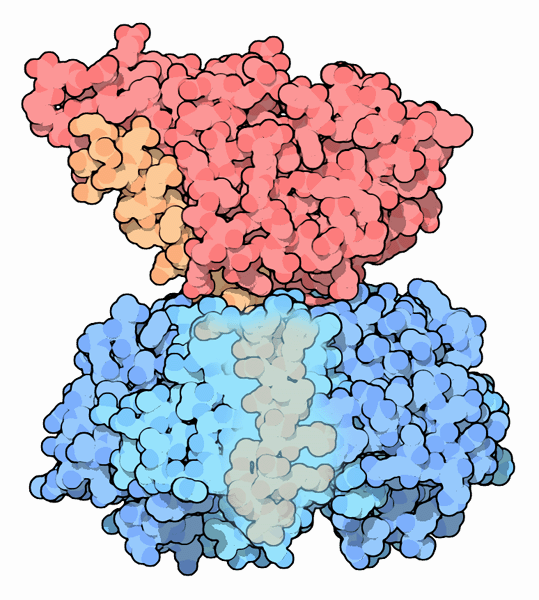 Introduzione IntroduzioneI batteri non tirano pugni quando lottano per difendersi, ma adottano strategie diverse. Alcuni batteri, come ad esempio il vibrione del colera, sintetizzano tossine così potenti che una singola molecola può uccidere una cellula intera. Una simile tossina è molto più efficace dei più potenti veleni chimici come il cianuro o l'arsenico. I veleni chimici attaccano molecole importanti per la vita e vi si legano strettamente, quindi sono necessarie moltissime molecole di cianuro per uccidere una cellula. Le tossine batteriche, invece, usano due diverse strategie per trasformarsi in agenti molto più mortali di così. Costruire una tossina mortale La prima strategia usata per costruire tossine super-mortali consiste nell'adottare un meccanismo di ancoraggio al bersaglio per portare direttamente la tossina alla cellula da colpire. La tossina del colera mostrata qui a destra (file PDB 1xtc) ha un anello di cinque catene proteiche identiche, blu, che si legano ai carboidrati sulla superficie delle cellule. In questo modo anche la porzione tossica della molecola (rossa) giunge sulla cellula dove può iniziare l'opera di devastazione. La seconda strategia per avere tossine super-mortali consiste nell'usare un enzima tossico invece di un veleno chimico. Gli enzimi, infatti, sono progettati per compiere più e più volte la loro reazione, e quindi aggrediscono una ad una le molecole bersaglio e le trasformano chimicamente. Così, anche un solo enzima può modificare milioni di molecole. La tossina del colera usa questa strategia quando si trova all'interno delle cellule. La porzione tossica attacca le molecole bersaglio trasformandole tutte, una alla volta, finché la cellula muore. Tossina del colera in azione La porzione catalitica della tossina del colera compie una singola funzione: cerca le proteine G (mdm 10-2004) addette alle segnalazioni cellulari e vi introduce una molecola di ADP al posto del normale GTP che legano normalmente. Questo mette la proteina G in uno stato di costante attivazione che la costringe ad inviare un segnale ininterrotto. Questo confonde la cellula che, fra le altre cose, comincia a trasportare verso l'esterno acqua e sodio che inondano l'intestino e producono una disidratazione (diarrea) devastante.  Tossine
terribili Tossine
terribili La doppia strategia adottata dalla tossina del colera è estremamente efficace al punto che viene usata da molti altri organismi che cercano di proteggersi. Alcuni esempi, presi dagli archivi PDB, sono mostrati qui a destra, con la porzione di ancoraggio al bersaglio in blu e l'enzima tossico in rosso. L'enterotossina di E. coli (file PDB 1ltb) assomiglia e si comporta come la tossina del colera e causa i noti problemi intestinali del viaggiatore. La tossina della pertosse (file PDB 1prt), prodotta dal batterio della tosse canina, attacca, come la tossina del colera, il processo di segnalazione delle proteine G (mdm 10-2004). La tossina della difterite (file PDB 1mdt) è sintetizzata come una singola catena, ma poi, quando viene rilasciata, viene tagliata per formare le due parti della tossina matura. Blocca la sintesi delle proteine nelle cellule attaccando uno dei fattori di allungamento (mdm 9-2006). La ricina (file PDB 2aai) (mdm 5-2013) è una potente tossina prodotta dalla pianta del ricino (ricinus communis). Quando entra nelle cellule, blocca la sintesi delle proteine attaccando direttamente i ribosomi (mdm 1-2010).  Esplorando
la struttura Esplorando
la struttura La struttura qui a destra (file PDB 1ltt) mostra come l'enterotossina di E. coli trova le sue cellule bersaglio nell'intestino. La struttura include cinque molecole di un semplice carboidrato, il lattosio, (sfere grigie e rosse in basso) legate alla porzione di ancoraggio al bersaglio della tossina (azzurra). Le catene di carboidrati sulla superficie della cellula si legano in questi stessi punti quando la tossina tocca la superficie cellulare. Si può anche vedere come viene rilasciata la porzione tossica. Si nota una lunga catena (color sabbia) che lega la porzione tossica (rosa) al dominio di ancoraggio. Quando la tossina viene attivata, il piccolo segmento che connette queste due parti (vicino all'asterisco) viene eliminato ed un ponte disolfuro viene rotto (due sfere gialle) per rilasciare la porzione tossica (rosa) nella cellula. Il piccolo segmento è deformato in questa struttura, così la catena sembra già rotta. R.-G. Zhang, D. L. Scott, M. L. Westbrook, S. Nance, B. D. Spangler, G. G. Shipley and E. M. Westbrook. (1995) The Three-Dimensional Crystal Structure of Cholera Toxin. Journal of Molecular Biology 251, 563-573. T. K. Sixma, S. E. Pronk, K. H. Kalk, B. A. M. vanZanten, A. M. Berghuis, W. G. J. Hol. (1992) Lactose Binding to Heat-Labile Enterotoxin Revealed by X-ray Crystallography. Nature 355, 561-564.
|
||||||
|
|
||||||
