|
Molecola del mese di ottobre 2004
Le proteine G sono composte da tre subunità,
ricevono segnali dai recettori di membrana e li trasmettono all'interno
della cellula
 Introduzione Introduzione
Le cellule comunicano scambiandosi una con l'altra
piccoli messaggi molecolari. Alcuni di questi vengono trasportati dal
flusso sanguigno e possono raggiungere le zone più distanti del
corpo. Altri messaggi, invece, diffondono verso le cellule vicine che
li raccolgono e li leggono. Nel corpo umano vengono trasmessi migliaia
di messaggi diversi. Tra gli esempi più noti vi è l'adrenalina
(mdm 4-2008 ) che controlla il livello di eccitazione, il glucagone
(mdm 4/2015) che, insieme all'insulina, controlla il livello di glucosio
nel sangue, l'istamina che segnala i danni ai tessuti e la dopamina
(mdm 3-2014) un neurotrasmettitore.
Leggere i messaggi
In molti casi, questi messaggeri molecolari non
entrano nelle cellule. Il messaggero si lega ad un recettore sulla superficie
cellulare ed il segnale viene tramesso all'interno attraverso una catena
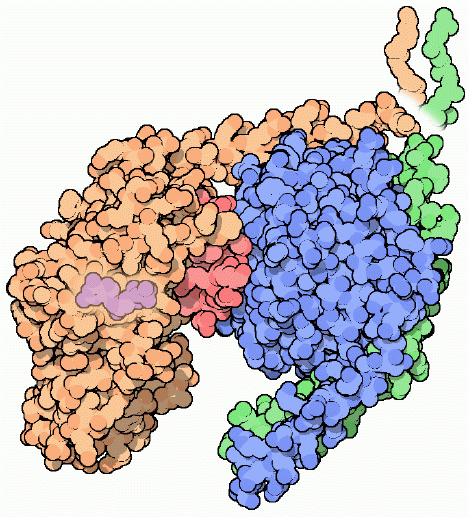
di molecole di segnalazione. Le proteine G, come quella mostrata qui
a destra (file PDB 1gg2), sono l'anello
centrale in questa catena di comunicazione. Il sistema delle proteine
G è il metodo più comune di segnalazione nelle nostre
cellule. Esistono migliaia di recettori accoppiati a proteine G,
ognuno in attesa del suo particolare messaggero. Alcuni riconoscono
gli ormoni e regolano il metabolismo. Altri riconoscono i neurotrasmettitori
che portano il segnale nervoso da un neurone al successivo. Il nostro
senso della vista utilizza un sistema di proteine G sensibile
alla luce (rodopsina
mdm 3-2012) e il nostro senso dell'odorato utilizza migliaia
di recettori, ognuno in grado di riconoscere l'odore di una diversa
molecola.
Tutti questi recettori quando ricevono il loro segnale sono accoppiati
ad una particolare proteina G che lo trasmette all'interno della cellula.
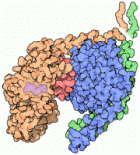
La "G" delle proteine G
Le proteine G sono interruttori molecolari che usano
GDP (guanosina-di-fosfato, magenta nella figura qui sopra, a
sinistra) per controllare il loro ciclo di segnalazione. Quando GDP
è legato, come nella figura qui a lato, la proteina G è
inattiva. Per attivarla, il GDP viene sostituito con GTP (guanosina-tri-fosfato),
così la proteina G può portare il suo segnale, come mostrato
più sotto. Le proteine G possono avere forma e dimensioni molto
diverse. La maggior parte di loro svolge un ruolo di segnalazione
nella cellula, ma alcune hanno compiti diversi, come per esempio
promuovere la sintesi di proteine. Quelle descritte qui sono
chiamate proteine G trimere perché sono composte di tre
catene diverse, chiamate alfa (marrone chiaro e rosso), beta
(blu), e gamma (verde). La piccola porzione rossa è un
tratto di catena alfa che è importante per trasmettere il segnale.
Legarsi alla membrana
Queste proteine G si legano alla superficie interna
della membrana cellulare, e quindi sono vicine ai loro recettori. Molti
piccoli lipidi sono legati alle tre catene della proteina G (due
piccole catene in alto a destra nella figura qui sopra), questi si inseriscono
nella membrana cellulare e così vi fanno aderire la proteina
G. Comunque, non cercate di trovare questi piccoli lipidi nella struttura
cristallina del file PDB 1gg2, perché
sono stati rimossi per permettere la cristallizzazione della proteina
e nella figura qui sopra sono stati solo disegnati.
Proteine G sotto attacco
Il sistema delle proteine G ha un ruolo centrale
in molti processi di segnalazione, e questo le rende un facile bersaglio
per farmaci e tossine. Molti farmaci, come Claritin e Prozac
e anche molte droghe come eroina, cocaina e marijuana
agiscono sui recettori accoppiati alle proteine G. I batteri del colera
producono una tossina
(mdm 9-2005) che attacca direttamente le proteine G, legando un nucleoside
(ADP) in un punto strategico. Questa modifica rende le proteine G costantemente
attive. Questo fa saltare i normali controlli sul bilancio dei liquidi
nelle cellule intestinali, e la persona infettata si disidratata rapidamente
perdendo acqua e sali minerali.
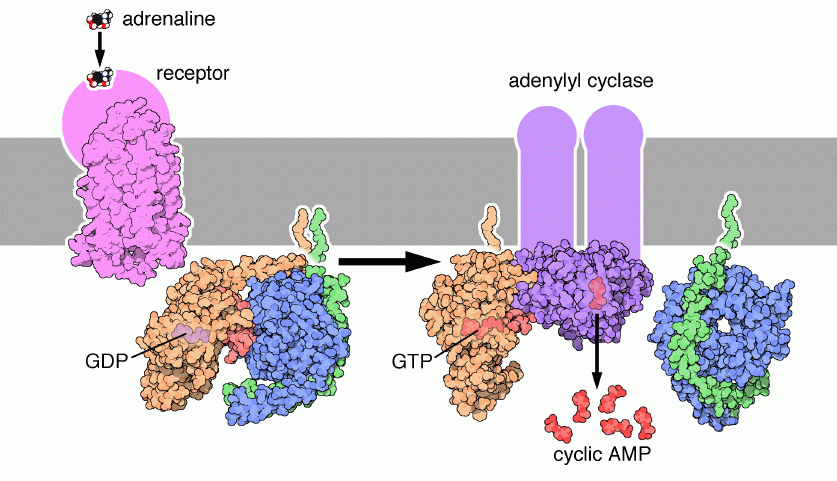
Trasmettere il segnale
Le proteine G trasmettono i loro segnali sulla superficie
interna della membrana cellulare. Il processo comincia quando un recettore
lega il corrispondente ormone o neurotrasmettitore, nell'esempio
qui sopra l'adrenalina. Questo legame fuori dalla cellula cambia
la forma del recettore, che si lega alla proteina G inattiva
sul lato interno della membrana. Questo legame induce la proteina G
ad espellere una molecola di GDP e a sostituirla con GTP.
Il GTP fa cambiare la forma di un piccolo tratto di catena (rosso).
La struttura trimera della proteina G diventa instabile e
si separa in due frammenti, da un lato la catena alfa e dall'altro
le catene beta e gamma.
La subunità alfa, col GTP legato, si muove lungo
la membrana finché si lega all'enzima adenilil ciclasi
e lo attiva. L'adenilil ciclasi attivato produce molto AMP
ciclico che diffonde il segnale all'interno della cellula. Infine,
la subunità alfa si disattiva da sola, infatti, dopo qualche
istante, rompe il GTP formando GDP, si stacca dall'enzima adenil
ciclasi e si unisce all'altro frammento beta-gamma ricostruendo la
proteina G trimera inattiva, pronta per eseguire un altro ciclo.
. . . . . . . . 
Un vantaggio notevole di questo meccanismo è che permette di
amplificare notevolmente il segnale. In questa catena di segnalazione,
una sola molecola di adrenalina fuori dalla cellula può stimolare
la produzione di molte molecole di AMP ciclico all'interno. Incorporando
un enzima (adenilil ciclasi) nella catena, un segnale debole
proveniente dall'esterno della cellula può essere tradotto in
un segnale molto più forte che pervade l'interno della
cellula.
Per realizzare la figura qui sopra sono state utilizzate quattro strutture
PDB, da sinistra a destra: 1f88, 1got,
1cul, e 1tbg.
Queste non sono le proteine esatte che rispondono all'adrenalina, ma
danno un'idea di come è strutturato un sentiero di segnalazione.
Esplorando la struttura
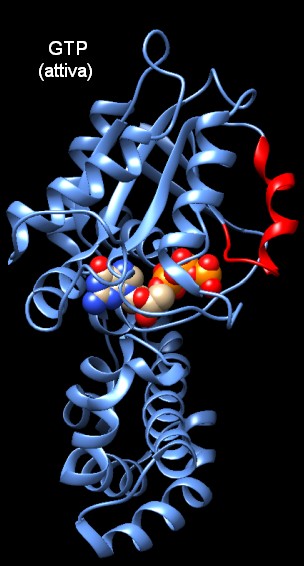
Le proteine G usano GTP per diventare attive.
Nella forma attiva, mostrata qui sotto sulla sinistra (file PDB 1gia)
l'ultimo gruppo fosfato del GTP arriva a toccare un corto tratto
di catena (rosso) sulla superficie della proteina, legandolo e trattenendolo
vicino a sè. Il GTP è mostrato con sfere colorate con
il fosforo giallo e gli ossigeni rossi.
Quando il GTP viene trasformato in GDP, l'ultimo gruppo fosfato viene
perso, e la molecola di GDP, più corta, non arriva
a toccare il filamento rosso e quindi non lo trattiene vicino a sè.
Il filamento rosso assume una conformazione più rilassata
che gli consente di legarsi alla subunità beta (verde).
Questo è ben visibile nel complesso inattivo trimero illustrato
qui sotto a destra (PDB 1gg2).

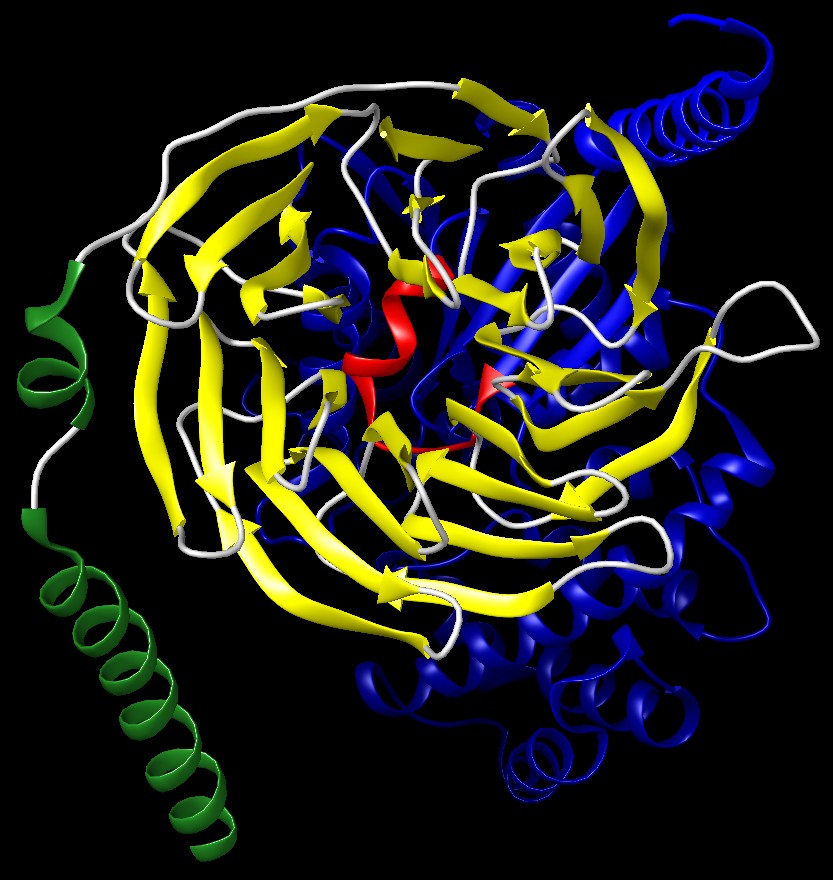
La subunità beta (verde) mostrata qui sopra ha una struttura
interessante: è formata di tanti segmenti a foglietto beta
affiancati.
Questa strana struttura si può comprendere meglio guardando la
figura qui sotto (file PDB 1gg2) nella
quale i tratti beta pieghe sono stati evidenziati in giallo. La struttura
complessiva beta a pieghe (gialla) ha una forma a canestro
che le consente di accogliere meglio al suo interno il peptide mobile
(rosso) della subunità alfa (qui mostrata in blu) per generare
la forma inattiva della proteina G.
. . . . . . . . .. . 
 Bibliografia Bibliografia
S. R. Sprang (1997) G protein mechanisms:
insights from structural analysis. Annual Review of Biochemistry
66, 639-678.
H. R. Bourne (1997) How receptors talk to trimeric G proteins.
Current Opinion in Cell Biology 9, 134-142.
D. E. Coleman and S. R. Sprang (1996) How G proteins work. Trends
in Biochemical Sciences 21, 41-44.
J. R. Hepler and A. G. Gilman (1992) G proteins. Trends in
Biochemical Sciences 17, 383- 387.
M. E. Linder and A. G. Gilman (1992) G proteins. Scientific
American 267(1), 56-65.
|
|
|
 Introduzione
Introduzione



