|
Molecola del Mese di Ottobre 2016
Gli inibitori della dipeptidil peptidasi 4 sono usati per la cura del
diabete di tipo 2
 Introduzione Introduzione
Vi siete mai chiesti come fa il nostro corpo a regolare
i suoi processi, in modo che ogni cellula abbia esattamente le risorse
di cui ha bisogno? Questa delicata regolazione, chiamata omeostasi,
è realizzata con una continua comunicazione e cooperazione tra
le cellule dei diversi distretti del corpo. Una delle principali omeostasi
è quella che regola il livello di glucosio nel sangue realizzata
da una serie di ormoni tra cui insulina
(mdm 2-2001 e 2-2015)
e glucagone
(mdm 4-2015). Quando mangiamo, le cellule del sistema digerente secernono
incretine, ormoni che comunicano al corpo che il glucosio è disponibile
nel sangue. Questi ormoni vanno al pancreas e lo inducono a rilasciare
insulina che segnala alle cellule del corpo, come quelle del muscolo
o del fegato, di incamerare glucosio e di trattenerlo per un uso successivo.
Quando i livelli di glucosio scendono, lontano dai pasti, l'ormone glucagone
dice alle cellule di rilasciare il glucosio che hanno accumulato. I
due effetti complementari di insulina e glucagone sono controllati dal
livello di incretine ed assicurano che la concentrazione di glucosio
nel sangue rimanga sempre vicino al valore ideale che ne consente il
consumo da parte delle cellule che ne hanno bisogno, senza però
mai superare un certo livello. Un eccesso di glucosio nel sangue è
pericoloso per le proteine del nostro corpo, che, reagendo col glucosio,
vengono alterate in modo permanente.
Dipeptidil peptidasi 4 (DPP4)
Dato che gli ormoni controllano momento per momento
le funzioni del nostro corpo, i loro segnali devono variare rapidamente
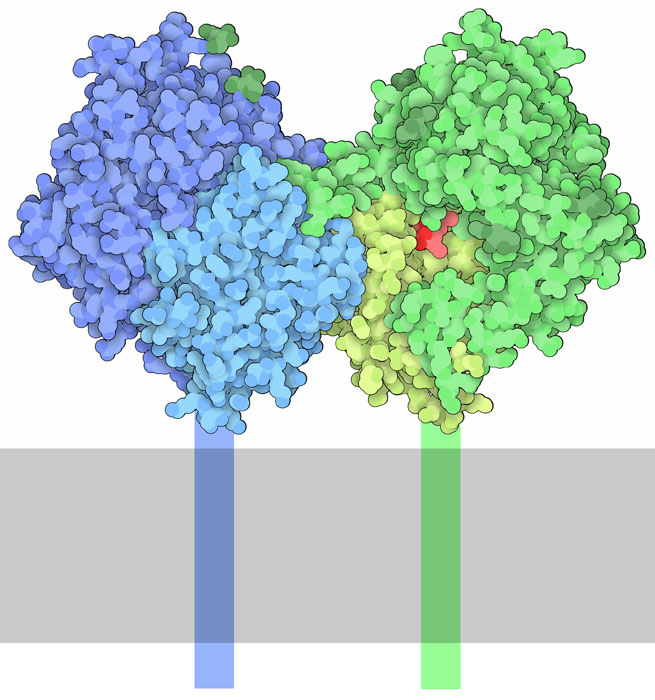
quando cambiano le condizioni. Dipeptidil Peptidasi 4 (DPP4) mostrata
qui sopra dal file PDB 1nu8, contribuisce
a realizzare questa regolazione. Si tratta di una proteina legata alla
membrana che è formata da due subunità identiche mostrate
qui in blu e verde. Ognuna contiene due domini. Il dominio nella parte
superiore di ogni subunità interagisce con altre proteine extracellulari,
mentre il dominio in basso contiene la triade di amminoacidi del sito
attivo. DPP4 si trova sulla superficie delle cellule di tutto il corpo
e svolge più ruoli: interagisce con molte proteine ed è
essenziale nella segnalazione cellulare e nell'infiammazione e disattiva
numerosi ormoni, incluse le incretine, tagliando due amminoacidi (un
dipeptide) dalla coda della loro catena proteica. Dato che ci sono molte
DPP4 in giro, le incretine (come GLP1 e GIP) possono circolare solo
per pochi minuti prima di essere disattivate e questo consente di realizzare
una comunicazione efficace tra le cellule che producono incretina nell'intestino
e i loro bersagli, le cellule che producono insulina e glucagone nel
pancreas.
Tagliare peptidi
DPP4 taglia il legame ammidico degli ormoni bersaglio
che hanno prolina o alanina nella posizione n° 2
della catena. La reazione di taglio è realizzata da una triade
di amminoacidi simile a quella delle proteasi alla serina come tripsina
(mdm 10-2003), chimotripsina ed elastasi. Una serina realizza
la reazione di taglio ed è attivata da una istidina e
da un acido aspartico. Due acidi glutammici aiutano la reazione
legandosi all'amminoacido terminale della catena dell'ormone e trattenendolo
nella posizione ideale. DPP4 è uno dei pochi enzimi in grado
di tagliare una catena proteica vicino ad una prolina, e ci riesce grazie
ad una tasca apolare nella quale può alloggiare perfettamente
la prolina. La comprensione delle interazioni tra DPP4 e gli ormoni
che deve tagliare, ha permesso di sviluppare inibitori per DPP4.
Substrati di DPP4
 DPP4
taglia ormoni peptidici come le incretine, il neuropeptide Y (file PDB
1ron), la chemochina eotaxina (file PDB 1eot),
e così consente che questi siano attivi solo quando servono.
Tutti questi ormoni hanno una struttura simile, con prolina o
alanina nella seconda posizione della catena. DPP4
taglia ormoni peptidici come le incretine, il neuropeptide Y (file PDB
1ron), la chemochina eotaxina (file PDB 1eot),
e così consente che questi siano attivi solo quando servono.
Tutti questi ormoni hanno una struttura simile, con prolina o
alanina nella seconda posizione della catena.
I due ormoni incretina, GLP-1 (glucagon-like peptide-1, file PDB 1d0r)
e GIP (glucosio-dipendente insulino-tropic polipeptide, file PDB 2b4n),
si sono rivelati di particolare interesse per la cura del diabete
di tipo 2.
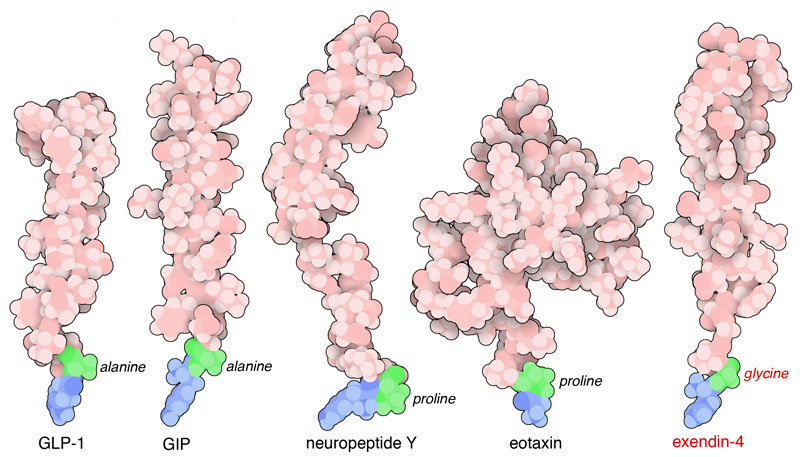
Nella figura qui a fianco sono mostrati quattro substrati di DPP4 e
un suo inibitore. Nei quattro substrati, i due amminoacidi terminali
in basso, in blu e verde, vengono tagliati da DPP4 e rilasciati come
dipeptidi. La quinta struttura è l'inibitore exendina-4 (file
PDB 1jrj) che non può essere tagliato
perchè ha un amminoacido di glicina nella seconda posizione
che non viene riconosciuto da DPP4.
Curare il diabete di tipo 2
Le persone con il diabete mellito hanno livelli
pericolosamente alti di glucosio nel sangue a causa di un basso livello
di insulina. Una delle strategie di cura consiste nell'inibire DPP4
in modo da consentire alle incretine di agire più a lungo e stimolare
la produzione di insulina. I ricercatori hanno cercato di ottenere questo
risultato in due modi.
Con il primo, hanno sviluppato analoghi di GLP-1 e GIP, cioè
ormoni che non possono essere rotti da DPP4. Per esempio, il farmaco
exenatina è stato sviluppato da exendina-4 (file PDB 1jrj)
una molecola simile alle incretine che si trova nel veleno del Mostro
di Gila, uno strano sauro dalla coda tozza del nord America. Questa
molecola, dato che non viene tagliata da DPP4, può restare nel
sangue più a lungo e così stimola la produzione di più
insulina e aiuta a diminuire i livelli ematici di glucosio. Dato però
che questi analoghi delle incretine sono piccole proteine, devono essere
somministrate per iniezione.
Con il secondo approccio si usano farmaci che possono essere assunti
per bocca per bloccare l'azione di DPP4 per consentire alle nostre incretine
naturali di circolare più a lungo nel sangue.
 Esplorando
la struttura Esplorando
la struttura
(Inibitori delle DPP4)
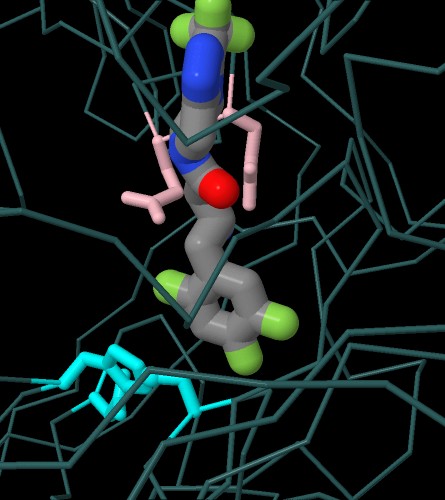
Nel 2006 la FDA Food and Drug Administration ha
approvato il primo farmaco inibitore di DPP4, la sitagliptina
(mostrata nella figura qui a fianco, file PDB 1x70)
che è stata subito seguita da molti altri farmaci anti diabete
di tipo 2 chiamati collettivamente gliptine. Tutti questi farmaci
mimano la parte terminale della coda delle incretine e così bloccano
il sito attivo di DPP4 impedendogli di disattivare gli ormoni.
Se passate con il mouse sull'immagine qui a destra, potete confrontare
il farmaco sitagliptina con un analogo del substrato naturale
(file PDB 1nu8) che possiede una prolina
nella seconda posizione, riconoscibile per l'anello a cinque atomi sulla
destra, che include un azoto (blu).
La sitagliptina, al posto della prolina, ha un anello benzenico legato
a tre atomi di fluoro (verdi) che viene riconosciuto dalla DPP4, ma
la molecola non può essere tagliata perchè non è
un peptide.
In basso nella figura, si vede la triade di amminoacidi del sito
attivo (in ciano) che realizza il taglio del peptide. Da destra verso
sinistra: serina, istidina, acido aspartico.
Nelle immagini qui sotto sono mostrate altre cinque di queste gliptine
riprese dalla stessa angolazione nel sito attivo della DPP4.
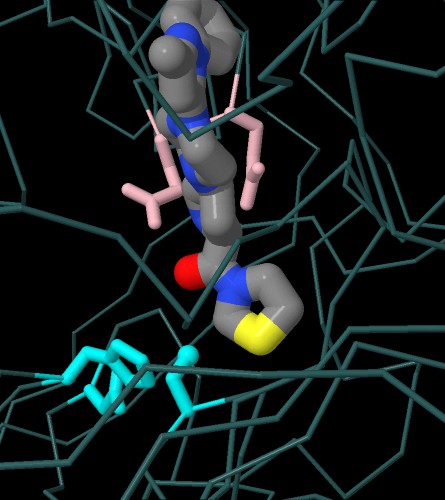
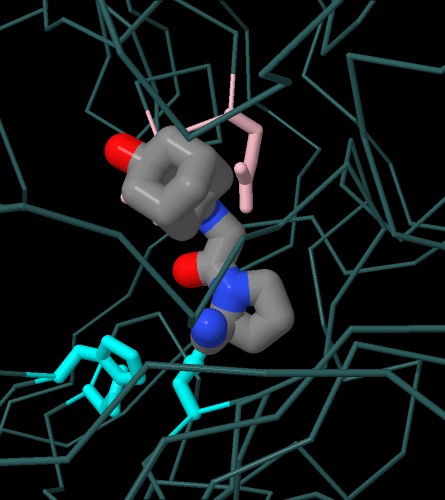
Nella prima immagine interattiva qui sotto a sinistra
si vede il farmaco teneligliptina (file PDB 3vjk)
sovrapposto ad un analogo del substrato naturale (file PDB 1nu8).
Anche qui, del farmaco, si nota l'anello a cinque in basso nella stessa
posizione della prolina del substrato.
 . . . . . . . .
. . . . . . . . 
Nell'immagine interattiva qui sopra a destra si vedono altri due farmaci
vildagliptina (file PDB 3w2t) e saxagliptina
(file PDB 3bjm) e si nota anche qui che
imitano la struttura dell'anello della prolina (in centro a destra).

Infine, nell'ultima immagine qui a fianco, si vedono i due farmaci alogliptina
(file PDB 3g0b) e linagliptina
(file PDB 2rgu).
Spunti per ulteriori esplorazioni
Le strutture di molti altri ormoni che sono tagliati
da DPP4 sono disponibili nel PDB, compreso il peptide YY (file PDB 2dez)
e la chemochina RANTES (file PDB 1rtn).
Date un'occhiata a queste molecole e trovate il dipeptide che è
tagliato da DPP4.
Usate la "Protein Feature View" di
DPP4 per vedere le porzioni dell'enzima che non sono incluse
nella struttura.
 Bibliografia Bibliografia
D. Rohrborn, N. Wronkowitz & J. Eckel
(2015) DPP4 in diabetes. Frontiers in Immunology 6, article 386.
3w2t: M. Nabeno, F. Akahoshi, H. Kishida, I. Miyaguchi, Y. Tanaka,
S. Ishii & T. Kadowaki (2013) A comparative study of the binding
modes of recently launched dipeptidyl peptidase IV inhibitors in the
active site. Biochemical and Biophysical Research Communications 434,
191-196.
H. Zhong, X. Rao & S. Rajagopalan (2013) An emerging role
of dipeptidyl peptidase 4 (DPP4) beyond glucose control: potential implications
in cardiovascular disease. Atherosclerosis 226, 305-314.
3vjk: T. Yoshida, F. Akahoshi, H. Sakashita, H. Kitajima, M.
Nakamura, S. Sonda, M. Takeuchi, Y. Tanaka, N. Ueda, S. Sekiguchi, T.
Ishige, K. Shima, M. Nabeno, Y. Abe, J. Anabuki, A. Soejima, K. Yoshida,
Y. Takashina, S. Ishii, S. Kiuchi, S. Fukuda, R. Tsutsumiuchi, K. Kosaka,
T. Murozono, Y. Nakamaru, H. Utsumi, N. Masutomi, H. Kishida, I. Miyaguchi
& Y. Hayashi (2012) Discovery and preclinical trials of teneligliptin
(3-[(2S,4S)-4-[4-(3-methyl-1-phenyl-1H-pyrazol-5-yl)piperazin-1-yl]pyrrolidin-2-ylcarbonyl]thiazolidine):
a highly potent, selective, long-lasting and orally active dipeptidyl
peptidase IV inhibitor for the treatment of type 2 diabetes. Bioorganic
and Medicinal Chemistry 20, 5705-5719.
3g0b: Z. Zhang, M. B. Wallace, J. Feng, J. A. Stafford, R. J.
Skene, L. Shi, B. Lee, K. Aertgeerts, A. Jennings, R. Xu, D. B. Kassel,
S. W. Kaldor, M. Navre, D. R. Webb & S. L. Gwaltney (2011) Design
and synthesis of pyrimidinone and pyrimidinedione inhibitors of dipeptidyl
peptidase IV. Journal of Medicinal Chemistry 54, 510-524.
3bjm: W. J. Metzler, J. Yanchunas, C. Weigelt, K. Kish, H. E.
Klei, D. Zie, Y. Zhang, M. Corbett, J. K. Tamura, B. He, L. G. Hamann,
M. S. Kirby & J. Marcinkeviciene (2008) Involvement of DPP-IV catalytic
residues in enzyme-saxagliptin complex formation. Protein Science 17,
240-250.
2rgu: M. Eckhardt, E. Langkopf, M. Mark, M. Tadayyon, L. Thomas,
H. Nar, W. Pfrengle, B. Guth, R. Lotz, P. Sieger, H. Fuchs & F.
Himmelsbach (2007) 8-(3-(R)-aminopiperidin-1-yl)-7-but-2-ynyl-3-methyl-1-(4-methyl-quinazolin-2-ylmethyl)-3,7-dihydropurine-2,6-dione
(BI 1356), a highly potent, selective, long-lasting, and orally bioavailable
DPP-4 inhibitor for the treatment of type 2 diabetes. Journal of Medicinal
Chemistry 50, 6450-6453.
2b4n: I. Alana, J. C. Parker, V. A. Gault, P. R. Flatt, F. P.
O’Harte, J. P. Malthouse & C. M. Hewage (2006) NMR and alanine
scan studies of glucose-dependent insulinotropic peptide in water. Journal
of Biological Chemistry 281, 16370-16376.
1x70: D. Kim, L. Wang, M. Beconi, G. J. Eiermann, M. H. Fisher,
H. He, G. J. Hickey, J. E. Kowalchick, B. Leiting, K. Lyons, F. Marsilio,
M. E. McCann, R. A. Patel, A. Petrov, G. Scapin, S. B. Patel, R. S.
Roy, J. K. Wu, M. J. Wyvratt, B. B. Zhang, L. Zhu, N. A. Thornberry
& A. E. Weber (2005) (2R)-4-oxo-4-[3-(trifluoromethyl)-5,6-dihydro[1,2,4]triazolo[4,3-a]pyrazin-7(8H)-yl]-1-(2,4,5-trifluorophenyl)butan-2-amine:
a potent, orally active dipeptidyl peptidase IV inhibitor for the treatment
of type 2 diabetes. Journal of Medicinal Chemistry 48, 141-151.
1nu8: R. Thoma, B. Loeffler, M. Stihle, W. Huber, A. Ruf &
M. Hennig (2003) Structural basis of proline-specific exopeptidase activity
as observed in human dipeptidyl peptidase-IV. Structure 11, 947-959.
1d0r: X. Chang, D. Keller, S. Bjorn & J. J. Led (2001) Structure
and folding of glucagon-like peptide-1-(7-36)-amide in trifluoroethanol
studied by NMR. Magnetic Resonance Chemistry 39, 477-483.
1jrj: J. W. Neidigh, R. M. Fesinmeyer, K. S. Prickett & N.
H. Andersen (2001) Exendin-4 and glucagon-like-peptide-1: NMR structural
comparisons in the solution and micelle-associated states. Biochemistry
40, 13188-13200.
1eot: M. P. Crump, K. Rajarathnam, K. S. Kim, I. Clark-Lewis
& B. D. Sykes (1998) Solution structure of eotaxin, a chemokine
that selectively recruits eosinophils in allergic inflammation. Journal
of Biological Chemistry 273, 22471-22479.
1ron: S. A. Monks, G. Karagianis, G. J. Howlett & R. S. Norton
(1996) Solution structure of human neuropeptide Y. Journal of Biomolecular
NMR 8, 379-390.
|
|
|