|
|
Emoagglutinina H5 |
|||||
|
Molecola del mese di febbraio 2025 Proteina sulla superficie del virus dell'influenza aviaria H5N1 che si lega all'acido sialico all'estremità dei glicani sulla menbrana cellulare. 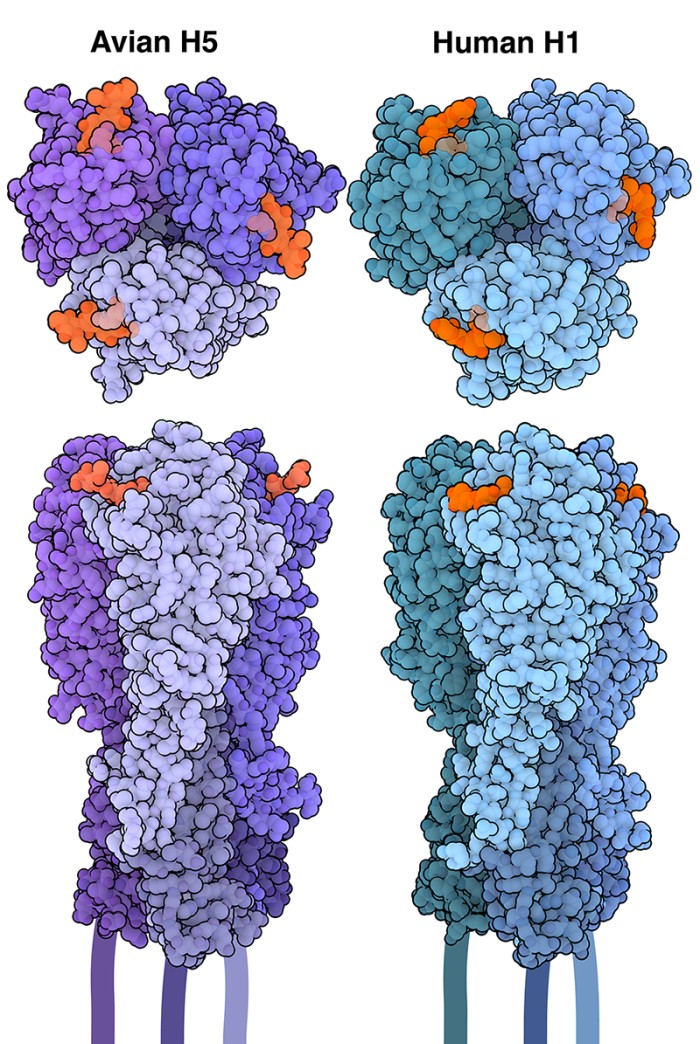 Introduzione IntroduzioneDalla sua prima comparsa nel 1996, l'influenza aviaria H5N1 (nota anche solo come "influenza aviaria") ha causato la morte e l'abbattimento di milioni di uccelli in tutto il mondo, causando significative perdite economiche per l'industria avicola e sollevando allarmi sulle popolazioni di uccelli selvatici a rischio. Focolai recenti hanno provocato malattie non solo negli uccelli, ma anche nei mammiferi selvatici e domestici. Un assortimento di sottotipi L'emoagglutinina (mdm 4-2006) è una proteina a forma di punta che, insieme alla neuraminidasi (mdm 5-2009), copre la superficie dei virus dell'influenza. Attualmente ci sono 18 sottotipi noti di emagglutinina (da H1 a H18) e 11 sottotipi noti di neuraminidasi (da N1 a N11). Diverse combinazioni di queste proteine determinano il sottotipo virale, come H1N1 o H3N2. Mentre gli esseri umani sono più spesso infettati da virus che ospitano emoagglutinine H1, H2 o H3, gli uccelli possono essere infettati da virus che esprimono quasi tutti i sottotipi di emoagglutinina (con l'eccezione di H17 e H18, che sono stati isolati dai pipistrelli). Solo due sottotipi di emoagglutinina, H5 e H7, causano tuttavia gravi malattie negli uccelli. Specificità dello zucchero Il virus dell'influenza è in grado di entrare e infettare le cellule attraverso l'azione dell'emoagglutinina, che riconosce e si lega a molecole specifiche sulla superficie cellulare. È stato scoperto che la maggior parte delle emoagglutinine prende di mira gli acidi sialici, una famiglia di molecole di zucchero a nove atomi di carbonio che si trovano comunemente alle estremità dei glicani, o catene di zuccheri, che sono attaccati a proteine e lipidi sulla superficie cellulare. L'acido sialico può essere legato ai glicani in modi diversi. I due tipi di legame più comuni sono chiamati legami alfa-2,3 e alfa-2,6. I virus dell'influenza aviaria, come H5N1 o H7N9, sono adattati per legarsi ai recettori dell'acido sialico legato alfa-2,3, che si trovano prevalentemente nel tratto respiratorio e gastrointestinale degli uccelli. (H5 aviario è mostrato qui sopra nei toni del viola, ID PDB 1JSN). Negli esseri umani, la maggior parte delle cellule del tratto respiratorio superiore (naso, gola e trachea) ha recettori dell'acido sialico legati alfa-2,6. I virus dell'influenza umana, come H1N1, sono adattati per legarsi a questi recettori, rendendoli più facilmente trasmissibili tra le persone (H1 è mostrato qui sopra nei vari toni del blu, ID PDB 1RVT). Oltrepassare la barriera di specie Nonostante la sua preferenza per gli uccelli, è noto che l'H5N1 può infettare anche gli esseri umani e altri mammiferi. Queste infezioni in genere si verificano per contatto diretto con uccelli infetti in ambienti affollati, come negli allevamenti di pollame o nei mercati di uccelli vivi. Sebbene la trasmissione da uomo a uomo di H5N1 sia molto rara e inefficiente, di recente sono stati segnalati numerosi casi di trasmissione tra mammiferi, tra cui un focolaio di H5N1 in più aziende lattiero-casearie negli Stati Uniti. La ricerca ha dimostrato che le ghiandole mammarie delle mucche sono ricche di recettori dell'acido sialico legati alfa-2,3, che consentono all'H5N1 di replicarsi e di essere rilasciato nel latte e, potenzialmente, di essere trasmesso ad altre mucche attraverso attrezzature di mungitura contaminate. Creazione di una cellula rivestita di zucchero 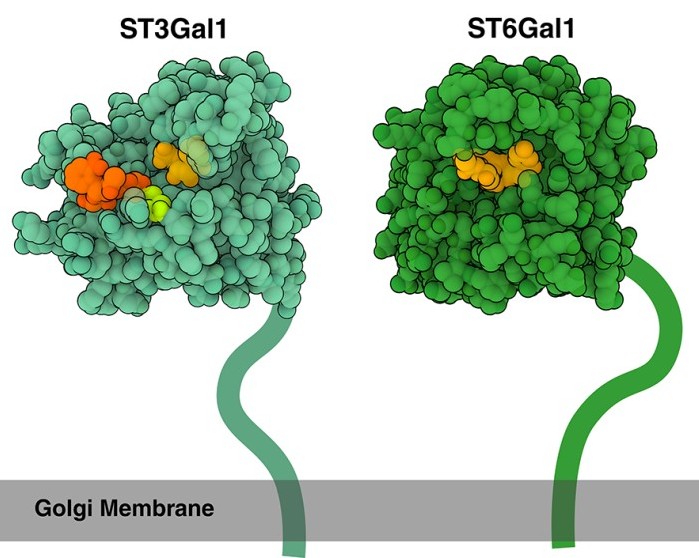 Gli
acidi sialici vengono aggiunti alle molecole della superficie cellulare
attraverso l'azione delle sialiltransferasi, enzimi che trasferiscono
l'acido sialico dalle molecole donatrici, come l'acido CMP-sialico, alle
molecole accettrici, come glicoproteine e glicolipidi. Gli
acidi sialici vengono aggiunti alle molecole della superficie cellulare
attraverso l'azione delle sialiltransferasi, enzimi che trasferiscono
l'acido sialico dalle molecole donatrici, come l'acido CMP-sialico, alle
molecole accettrici, come glicoproteine e glicolipidi. Le sialiltransferasi, che si trovano sulla membrana del Golgi, sono classificate in diverse sottofamiglie in base al tipo di legame glicosidico che formano: le alfa-2,3-sialiltransferasi (come ST3Gal-1, ID PDB 2WNB, mostrato in verde chiaro) aggiungono acido sialico ai residui di galattosio tramite un legame alfa-2,3, mentre le alfa-2,6-sialiltransferasi (come ST6Gal-1, ID PDB 6QVT, mostrato in verde più scuro) attaccano l'acido sialico al galattosio tramite un legame alfa-2,6. L'abbondanza di sialilazione della superficie cellulare, che è coinvolta in diversi processi tra cui il riconoscimento cellulare, la segnalazione e la differenziazione, la rende un bersaglio ideale per i virus. ST3Gal-1 (verde chiaro) e ST6Gal-1 (verde scuro) sono attaccati alla membrana del Golgi (grigio) con un filamento flessibile, che qui è disegnato in modo schematico. ST3Gal-1 è mostrato legato a una molecola di prodotto (arancione scuro) e ad uno zucchero accettore (arancione chiaro). La base catalitica è evidenziata in verde chiaro. ST6Gal-1 è mostrato legato a un acido sialico con legame alfa-2,6 (arancione chiaro). . . . . . .  Esplorando la struttura: salto di specie La ricerca ha dimostrato che un cambiamento in un singolo amminoacido può far sì che H5 si leghi preferenzialmente ai recettori umani/mammiferi (legati alfa-2,6) piuttosto che ai recettori aviari (legati alfa-2,3). In particolare, la sostituzione del residuo 226, che normalmente è una glutammina, con una leucina fornisce un ambiente più idrofobico che favorisce il legame con i recettori dei mammiferi. Nell'immagine qui sopra si vede come H5 (ID PDB 4K63 e 4K64) e H5 mutante (ID PDB 4K66 e 4K67) si legano ai recettori aviari e umani. Spunti per ulteriori esplorazioni Dopo aver riconosciuto e legato i recettori sulla superficie cellulare, l'emoagglutinina attacca le cellule in diversi passaggi. Leggi di più qui. Scopri gli altri componenti dell'influenza e come appare una sezione trasversale di un virus qui. Dai un'occhiata a come appare un vaccino antinfluenzale qui. 1JSN: Ha Y, Stevens DJ, Skehel JJ, Wiley DC. (2001) X-ray structures of H5 avian and H9 swine influenza virus hemagglutinins bound to avian and human receptor analogs. Proc Natl Acad Sci U S A. Sep 25;98(20):11181-6.. 1RVT: Gamblin SJ, Haire LF, Russell RJ, Stevens DJ, Xiao B, Ha Y, Vasisht N, Steinhauer DA, Daniels RS, Elliot A, Wiley DC, Skehel JJ. (2004) The structure and receptor binding properties of the 1918 influenza hemagglutinin. Science. Mar 19;303(5665):1838-42. 2WNF: Rao FV, Rich JR, Rakic B, Buddai S, Schwartz MF, Johnson K, Bowe C, Wakarchuk WW, Defrees S, Withers SG, Strynadka NC. (2009) Structural insight into mammalian sialyltransferases. Nat Struct Mol Biol. Nov;16(11):1186-8. 6QVT: Harrus D, Harduin-Lepers A, Glumoff T. (2020) Unliganded and CMP-Neu5Ac bound structures of human a-2,6-sialyltransferase ST6Gal I at high resolution. J Struct Biol. Nov 1;212(2):107628. 4K63, 4K64, 4K66, 4K67: Zhang W, Shi Y, Lu X, Shu Y, Qi J, Gao GF. (2013) An airborne transmissible avian influenza H5 hemagglutinin seen at the atomic level. Science. 2013 Jun 21;340(6139):1463-7. Mair CM, Ludwig K, Herrmann A, Sieben C. (2013) Receptor binding and pH stability - how influenza A virus hemagglutinin affects host-specific virus infection. Biochim Biophys Acta. 2014 Apr;1838(4):1153-68. Caserta LC, Frye EA, Butt SL, Laverack M, Nooruzzaman M, Covaleda LM, Thompson AC, Koscielny MP, Cronk B, Johnson A, Kleinhenz K, Edwards EE, Gomez G, Hitchener G, Martins M, Kapczynski DR, Suarez DL, Alexander Morris ER, Hensley T, Beeby JS, Lejeune M, Swinford AK, Elvinger F, Dimitrov KM, Diel DG. (2024) Spillover of highly pathogenic avian influenza H5N1 virus to dairy cattle. Nature. Jul 25. Harduin-Lepers, A. (2023) The vertebrate sialylation machinery: structure-function and molecular evolution of GT-29 sialyltransferases. Glycoconj J 40, 473–492.
|
||||||
|
|
||||||
