|
|
Hsp90 |
|||||
|
Molecola del Mese di Dicembre 2008 Le Heat Shock Proteins aiutano altre proteine a ripiegarsi nel modo corretto e a mantenere la loro forma attiva anche in condizioni sfavorevoli 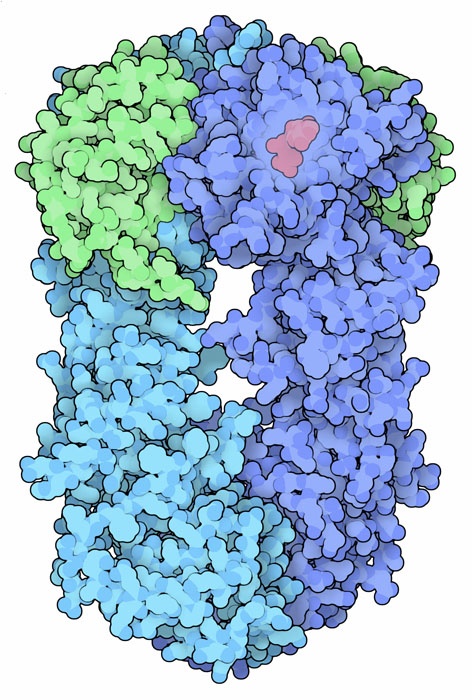 Introduzione IntroduzioneQuando le cellule vengono esposte a temperature troppo alte, producono una serie di proteine protettive dette proteine da shock termico, indicate con la sigla Hsp (Heat Shock Proteins) seguita da un numero che indica il peso molecolare. Molte di queste proteine sono chaperon (mdm 08-2002) che hanno il compito di mantenere le proteine della cellula avvolte in modo corretto e attive anche quando le condizioni ambientali diventano critiche. Le Hsp sono importanti non solo in caso di shock termico, ma anche nella vita normale della cellula, infatti aiutano le altre proteine a ripiegarsi e così limitano le pericolose aggregazioni di proteine immature. Alcune Hsp, come Hsp60 e Hsp70, sono generici chaperon, mentre altre, come Hsp90, hanno un ruolo più complesso. Clientela molecolare Hsp90 è un chaperon specializzato che aiuta la maturazione di una selezionata clientela di proteine. Tra queste ci sono più di cento fattori di trascrizione, moltissime chinasi, così come recettori di steroidi, proteine p53 mutanti (mdm 07-2002) e anche la proteina HER2 coinvolta nel cancro della mammella. Finora i ricercatori non hanno trovato un fattore comune a tutte queste proteine, hanno solo osservato che Hsp90 è indispensabile per preservarne la forma attiva. Sforzo comune L'esatta funzione di Hsp90 è ancora un mistero. I ricercatori non sanno esattamente cosa faccia per far maturare le proteine che assiste. Hanno scoperto che Hsp90 agisce come parte di un gruppo di proteine chaperon diverse. Alcuni di questi chaperon trasportano le proteine immature al complesso, mentre altri le aiutano a ripiegarsi. Il complesso mostrato qui a lato (file PDB 2cg9) comprende la proteina Hsp90, blu e azzurro, e la proteina co-chaperon Sba1, verde. E' anche presente una molecola di ATP, rossa, necessaria per il corretto funzionamento del complesso proteico. Connessione con il cancro Molte delle proteine assistite da Hsp90 sono regolatori della crescita cellulare e questo rende Hsp90 un obiettivo interessante per la chemioterapia del cancro. Dato che Hsp90 è indispensabile anche per le cellule sane, si potrebbe pensare che i farmaci che attaccano Hsp90 siano troppo tossici per essere usati nella terapia del cancro. Sembra però che le cellule cancerose dipendano da Hsp90 più di quelle normali e rispondano in modo più forte ai farmaci che bloccano la funzionalità di Hsp90. Per esempio, il farmaco geldanamicina impedisce il legame tra ATP e Hsp90 e così provoca l'accumulo nelle cellule cancerose di complessi di Hsp90 e di proteine ripiegate in modo errato. Questo induce il sistema ubiquitina-proteasoma (mdm 12-2004) a distruggere le proteine anomale e di conseguenza le cellule cancerose muoiono perchè la via di segnalazione che controlla la crescita cellulare è alterata. Braccia flessibili Hsp90 subisce grandi variazioni conformazionali durante il suo ciclo funzionale. La forma inattiva è aperta, come si vede nella figura qui sotto sulla sinistra (file PDB 2ioq). Il legame con ATP costringe la molecola a piegarsi e ad assumere la forma attiva chiusa, mostrata qui sotto sulla destra (file PDB 2cg9). Nella forma aperta vi sono due piccoli tratti di catena che sporgono alle estremità dalla proteina. Nella forma chiusa questi due segmenti creano un legame incrociato nella parte alta della proteina che stabilizza la struttura. Il sito di legame per l'ATP (visibile in rosso nella molecola sulla destra) si trova subito i due segmanti incrociati. Il cambio di forma locale che si genera quando l'ATP è legato provoca un cambiamento ben maggiore nella forma tridimensionale complessiva della proteina. . . . . . . . . . . . . . 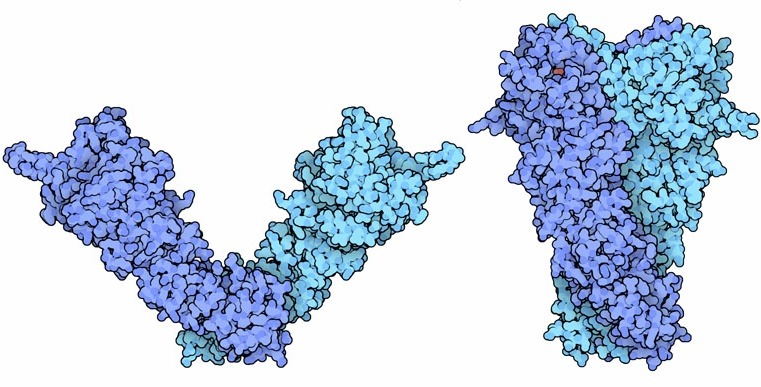 Negli archivi PDB sono disponibili molte forme diverse di Hsp90. La struttura aperta mostrata qui sopra sulla sinistra è una forma batterica, mentre quella chiusa sulla destra è di lievito. Negli archivi PDB è anche disponibile una struttura semi-chiusa di GRP94, una proteina simile a Hsp90 che si trova nel reticolo endoplasmatico (file PDB 2o1u e 2o1v, non mostrati qui). Esplorando la struttura Il primo farmaco scoperto capace di attaccare Hsp90 è stata una molecola di origine naturale, geldanamicina, prodotta dai batteri Streptomiceti e mostrata qui sotto a destra (file PDB 1yet). La geldanamicina si lega nel sito di legame dell'ATP della proteina Hsp90 e ne impedisce il legame con l'ATP e così rende impossibile il grande cambiamento conformazionale necessario per generare la forma attiva di Hsp90. Nell'immagine sulla sinistra si può vedere la proteina Hsp90 con ATP legato correttamente nel sito di legame (file PDB 1am1). Nella molecola di ATP sono presenti solo due dei tre gruppi fosfato, il terzo non è stato registrato perché era troppo mobile. Sfortunatamente la geldanamicina si è dimostrata così tossica da non poter essere utilizzata come farmaco anticancro, nel frattempo, però, sono stati individuati molti altri composti promettenti. La ricerca, quindi, continua. 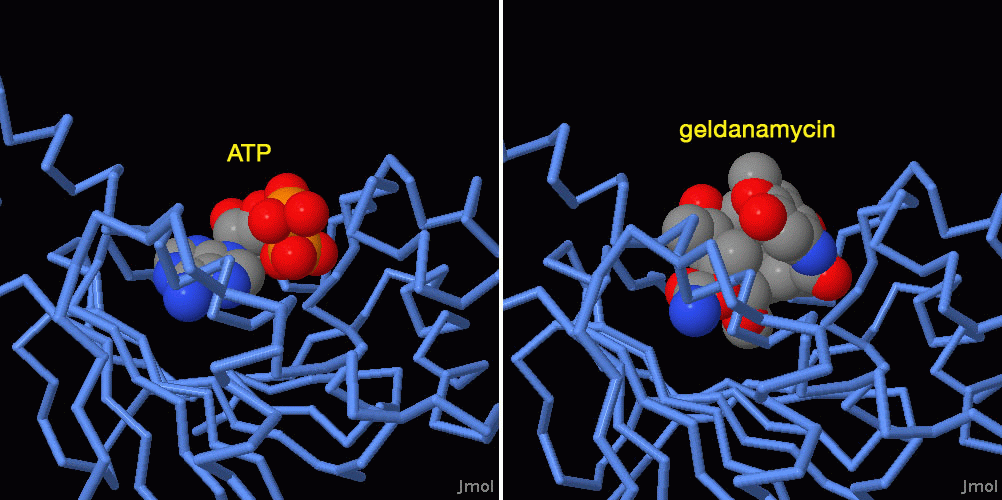 Spunti per ulteriori esplorazioni Provate ad individuare negli archivi PDB altre strutture proteiche che abbiano un farmaco legato al loro interno. La geldanamicina sembra molto diversa dall'ATP, ma i suoi punti di contatto con il sito di legame della proteina sono molto simili. Sapete individuare gli amminoacidi del sito di legame che interagiscono direttamente con ATP e geldanamicina? L. H. Pearl, C. Prodromou and P. Workman (2008) The Hsp90 molecular chaperone: an open and shut case for treatment. Biochemical Journal 410, 439-453. D. B. Solit, G. Choisis (2008) Development and application of Hsp90 inhibitors. Drug Discovery Today 13, 38-43. S. K. Wandlinger, K. Richter and J. Buchner (2008) The Hsp90 chaperone machinery. Journal of Biological Chemistry 283, 18473-18477. L. H. Pearl, C. Prodromou (2006) Structure and mechanism of the Hsp90 molecular chaperone machinery. Annual Review of Biochemistry 75, 271-294.
|
||||||
|
|
||||||
