|
|
Coronavirus proteasi | |||||
|
Molecola del mese di febbraio 2020 La proteasi del coronavirus è un bersaglio promettente per progettare farmaci antivirali 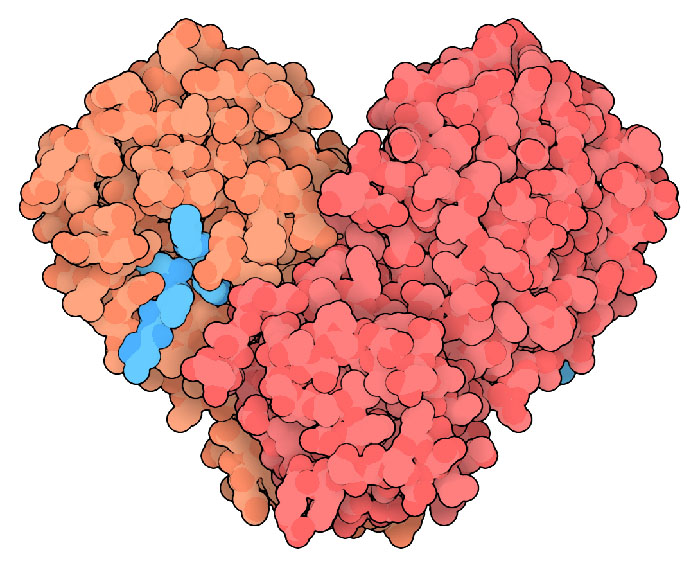 Introduzione IntroduzioneIn un mondo in cui i viaggi sono diventati facili e veloci, l'emergere di nuovi virus sta diventando un serio pericolo per la salute mondiale. Il coronavirus è un esempio notevole di questo problema. Forme particolarmente violente sono emerse dai loro ospiti naturali e costituiscono una grave minaccia per la comunità umana. Nel 2003, il virus SARS è emerso da una popolazione di pipistrelli, si è diffuso alle civette e da queste è passato all'uomo. Dieci anni dopo, il virus MERS, anche questo proveniente dai pipistrelli, si è trasmesso ai dromedari in medio oriente e da questi è passato all'uomo. Negli scorsi mesi un altro coronavirus è emerso in Cina dagli animali di un mercato di animali vivi a Wuhan e sta mietendo migliaia di vittime nel mondo mettendo in crisi l'economia dei paesi più colpiti. Mentre gli scienziati stanno cercando di mettere a punto un vaccino efficace, la biologia strutturale ci sta aiutando a capire i segreti di questo pericoloso nemico e ci darà nuove armi per combatterlo. Il codice del coronavirus Il coronavirus è un RNA virus (come HIV, mdm 6-2000) infatti contiene un lungo filamento di RNA, uno dei più lunghi della categoria. Quando il virus infetta le cellule, questo genoma agisce come un RNA messaggero e promuove la sintesi di due lunghe poliproteine che contengono tutti gli strumenti necessari per riprodurre nuovi virus. Queste proteine includono un complesso di replicazione e trascrizione che produce nuovo RNA, molte proteine strutturali per costruire le capsule dei nuovi virus e due proteasi. Queste ultime giocano un ruolo essenziale nel tagliare le due poliproteine per formare i frammenti funzionali. La proteasi principale La proteasi principale del coronavirus realizza la maggior parte di questi tagli. Quella mostrata qui in alto (file PDB 6lu7) è quella del coronavirus SARS-CoV-2 (COVID-19) che, partito da Wuhan, in questi giorni sta mettendo in grande difficoltà molte città della Cina e il mondo intero. E' un dimero formato da due subunità identiche che, insieme, creano due siti attivi. Il ripiegamento della proteina è simile a quello di altre proteasi come la tripsina (mdm 10-2003), ma la reazione di taglio è realizzata da una cisteina e una istidina (invece di serina e istidina) ed inoltre possiede un dominio in più che stabilizza il dimero. La struttura mostrata qui contiene, nel sito attivo, un unibitore (azzurro) che somiglia ad un peptide. Nella figura qui sotto, realizzata con Chimera, si notano sulla sinistra i due amminoacidi chiave cisteina (con lo zolfo giallo) e istidina con i due atomi di azoto blu) che si avvicinano al peptide (azzurro) e tentano di tagliarlo. . . 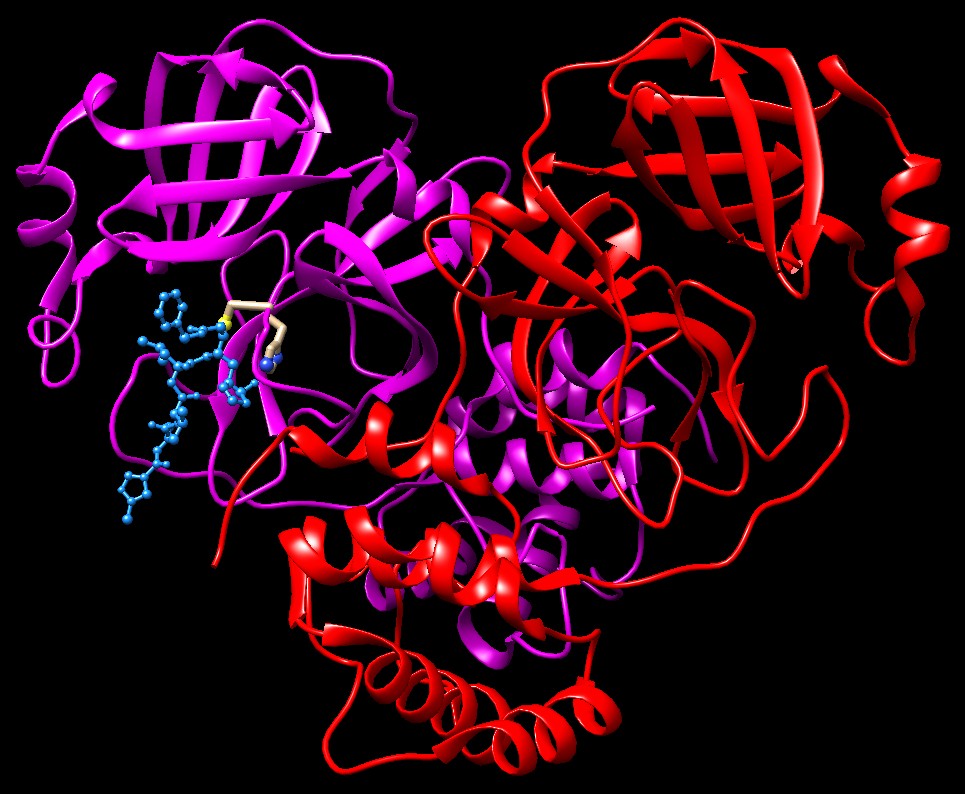  Proteasi
SARS Proteasi
SARSQui a fianco sono mostrate due proteasi del virus SARS. In alto si vede la proteasi principale (file PDB 1q2w) che è simile a quella del virus di Wuhan e taglia in 11 posizioni la poliproteina. In basso si vede la seconda proteasi simile alla papaina (file PDB 4ow0) che contiene un inibitore azzurro ed è composta da una sola subunità e taglia anch'essa con una cisteina. Fa due tagli specifici nella poliproteina SARS e anche taglia molte proteine nelle cellule infettate, tra l'altro rimuove l'ubiquitina (mdm 12-2004) dalle proteine marcate per la distruzione. Una conseguenza di questa de-ubiquitinazione è che interferisce con la produzione di interferone (mdm 8-2010) nel sistema immunitario innato azzerando alcune delle nostre difese contro i virus. 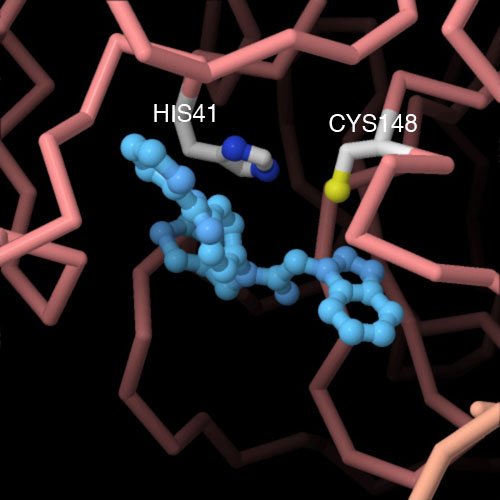 Esplorando la struttura
Esplorando la strutturaNella figura qui a lato è mostrato il sito attivo della proteasi principale del coronavirus di pipistrello nel quale è legato un inibitore azzurro. I ricercatori stanno usando questa struttura per individuare composti in grado di bloccare l'azione della proteasi e realizzare così un farmaco antivirale. La diversità tra i vari coronavirus rende più difficile l'impresa: i coronavirus sono classificati in quattro generi diversi che possiedono proteasi molto differenti e quindi un farmaco efficace contro un genere può essere inefficace contro gli altri. Una possibile strategia per affrontare il problema consiste nel progettare un inibitore ad ampio spettro per il progenitore del coronavirus di pipistrello come quello mostrato qui (file PDB 4yoi) che possa essere un punto di partenza per scoprire inibitori contro le nuove varianti del virus. I due amminoacidi chiave del sito attivo, cisteina e istidina, sono mostrati in dettaglio mentre si avvicinano all'inibitore azzurro. Spunti per ulteriori esplorazioni Una forma insolita, ottamerica, della proteasi principale può essere coinvolta nello stadio di maturazione. La potete trovare nel file PDB 3iwm. Provate a comparare l'avvolgimento della proteasi principale del coronavirus con quello della tripsina (una serina protesi). Per l'allineamento, usate lo strumento "Structure Align" e usate il tripsinogeno (PDB entry 1tgs), nel quale l'enzima è formato da una sola catena più lunga. Cui, J., Li, F., Shi, Z.L. (2019) Origin and evolution of pathogenic coronaviruses. Nat. Rev. Microbiol. 17, 181-192. 4yoi: St John, S.E., Tomar, S., Stauffer, S.R., Mesecar, A.D. (2015) Targeting zoonotic viruses: Structure-based inhibition of the 3C-like protease from bat coronavirus HKU4-The likely reservoir host to the human coronavirus that causes Middle East Respiratory Syndrome (MERS). Bioorg.Med.Chem. 23: 6036-6048 4ow0: Baez-Santos, Y.M., Barraza, S.J., Wilson, M.W., Agius, M.P., Mielech, A.M., Davis, N.M., Baker, S.C., Larsen, S.D., Mesecar, A.D. (2014) X-ray Structural and Biological Evaluation of a Series of Potent and Highly Selective Inhibitors of Human Coronavirus Papain-like Proteases. J.Med.Chem. 57: 2393-2412 Hilgenfeld, R. (2014) From SARS to MERS: crystallographic studies on coronaviral proteases enable antiviral drug design. FEBS J. 281,4085-4096 1q2w: Pollack, A. (2003) Company says it mapped part of SARS virus. New York Times, July 30, section C, page 2. |
||||||
|
|
||||||
