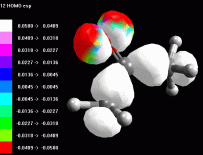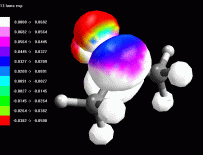|
Pianeta
Chimica.it Responsabile: Prof. Mauro Tonellato |
MODELLISTICA
MOLECOLARE CON ArgusLab
3^ LEZIONE ACETONE E TAUTOMERIA CHETO-ENOLICA |
||
|
Lezioni con
|
Gli argomenti di questa lezione sono:
|
||
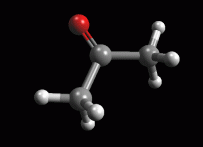
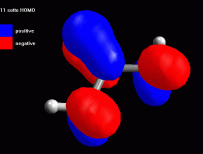
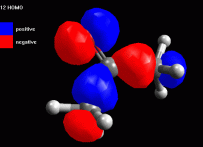
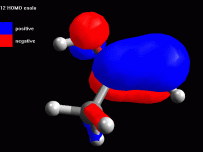
Creare la molecola di acetone Create la molecola dell'acetone ed ottimizzatela prima con UFF poi con AM1 più volte. Eventualmente ruotate manualmente i metili fino ad ottenere la conformazione della molecola in fig 1. Annotate l'entalpia di formazione calcolata da ArgusLab col metodo AM1 (dovreste ottenere circa -49,22 kcal/mol) Esaminare l'orbitale molecolare 11 Calcolate gli orbitali molecolari 11, 12 HOMO, 13 LUMO e inoltre calcolate i potenziali elettrostatici su tutta la molecola. Osservate per primo l'orbitale 11 (che chiamerete 11 sotto HOMO), si tratta dell'orbitale molecolare pigreco occupato a più alta energia (fig 2), ma non è questo l'orbitale HOMO. Notate comunque come i due metili sostituenti del carbonile contribuiscono alla sua stabilità delocalizzando parte della nuvola pigreco sui legami CH. Anche il carbonile è più stabile se è più sostituito. |
|||
|
|
|||
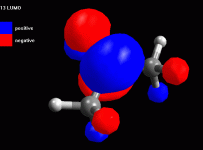
Esaminare l'orbitale 13 LUMO L'orbitale molecolare non occupato a più bassa energia (LUMO) è il 13. E' un orbitale di tipo pigreco. E' interessante osservare che si estende anche agli idrogeni in posizione alfa, cioè agli idrogeni legati ai carboni a fianco del carbonile (fig 5). Rappresentate l'orbitale 13 LUMO mappato con il potenziale elettrostatico. Regolate la dimensione dei lobi come in fig 6. Da questa immagine si vede molto bene che la zona più positiva (bianca) è quella in corrispondenza del carbonio del carbonile e dei quattro idrogeni in alfa. Se un nucleofilo attacca la molecola di acetone, fa giungere i suoi elettroni sull'orbitale LUMO, da questa immagine si vede molto bene che può legarsi in due posizioni diverse: a) può attaccare il carbonio del carbonile per fare una addizione nucleofila b) può attaccare gli idrogeni in alfa per produrre la tautomeria cheto enolica e dare luogo a quella famiglia di reazioni che ha l'enolo come intermedio. Esaminare l'orbitale 13 LUMO nell'acetone protonato E' interessante osservare come si trasforma l'acetone per opera della catalisi acida che protona l'ossigeno del carbonile. Costruite ed ottimizzate l'acetone protonato. Ricordate di settare a +1 la carica della molecola prima di ottimizzarla con AM1. Rappresentate l'orbitale 13 LUMO mappato con il potenziale elettrostatico (fig 7). Risulta più positivo non solo l'ossigeno , ma tutta la molecola assume potenziali maggiormente positivi come si può vedere in fig 7. L'intervallo dei potenziali è stato modificato da +0,20 a +0,33. Sia il carbonile che gli idrogeni in alfa risultano molto più positivi e quindi molto più reattivi per opera della catalisi acida. Notate anche la maggiore dimensione dei lobi sui carboni in alfa. |
|||
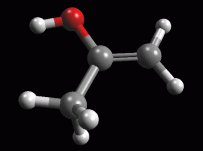
Creare la molecola dell'enolo Create la molecola dell'enolo ed ottimizzatela prima con UFF poi con AM1 più volte. Dovreste ottenere la molecola in fig 8. Annotate l'energia calcolata da ArgusLab col metodo AM1 (dovrebbe essere circa -39,43 kcal/mol) Confronta questa entalpia di formazione con quella calcolata prima per l'acetone. La differenza di energia tra le due molecole dovrebbe essere di circa 9,79 kcal/mol. Quindi per la reazione: acetone => enolo abbiamo calcolato DH = 9,79 kcal/mol Calcolate la K di equilibrio per la reazione di tautomeria cheto enolica applicando la relazione DG = - RT lnK da cui lnK = - DG / RT lnK = - 9,79 . 4184 / 8,31 . 298 = - 16,54 Approssimando DH a DG, dovreste ottenere un valore per K di circa 6,56 10-8 (in ottimo accordo con il valore sperimentale che è 6 10-9). Questo significa che per ogni molecola di enolo ci sono, all'equilibrio, 1,52 107 molecole di acetone. La quantità di enolo in equilibrio con il chetone è veramente molto modesta. |
|||
|
Autore: prof Mauro Tonellato |
|||
|
|
|
||
|
|
|||