|
Pianeta
Chimica.it
Responsabile:
Prof. Mauro Tonellato
|
|
MODELLISTICA
MOLECOLARE CON ArgusLab
7^ LEZIONE
CONFORMAZIONE DEGLI ALCANI
|
|
| |
|
|
|
|
Chimica al computer con
ArgusLab
 1-butene
e 2-butene 1-butene
e 2-butene
 Carbocatione
1° e 2° Carbocatione
1° e 2°
 Acetone
e tautomeria Acetone
e tautomeria
 Dieni
coniugati (pdf) Dieni
coniugati (pdf)
 Benzene
e aromaticità (pdf) Benzene
e aromaticità (pdf)
 Legame covalente
Legame covalente
 Conformazione alcani
Conformazione alcani
 Ponte Cloronio
Ponte Cloronio
 Diels-Alder
Diels-Alder
 Enolo
Mono e Disostituito (pdf)
Enolo
Mono e Disostituito (pdf)
Chimica al computer con
MGL Tools e AutoDock
 Struttura delle Proteine
Struttura delle Proteine
 Proteine e Legandi
Proteine e Legandi
 Docking su COX2
Docking su COX2
 Progettare
nuovi farmaci
Progettare
nuovi farmaci
 Chimica al Computer
Chimica al Computer
 PianetaChimica home
PianetaChimica home
|
|
Per seguire questa lezione dovete avere già visto la 1^ e la
2^ lezione di modellistica molecolare con ArgusLab nelle quali sono
state spiegate le procedure di base che qui verranno date per conosciute.
Arguslab 4.01 può essere scaricato gratuitamente qui:
http://www.arguslab.com
Questa lezione può essere affrontata in due modi:
1) Online. Potete leggere le istruzioni ed eseguirle passo passo
al computer con ArgusLab, aiutandovi con le illustrazioni che chiariscono
ogni passaggio.
2) In aula informatica con la classe. Se siete insegnanti di
chimica, potete adattare la lezione alle esigenze della vostra classe
e proporla in aula informatica ai vostri allievi.
La durata della lezione è di circa due ore.
N.B. Cliccando sulle immagini potrete vederle a pieno schermo.

Gli argomenti di questa lezione sono:
-- Conformazioni dell'etano e del butano
-- Calcolo delle barriere energetiche per la rotazione attorno al legame
sigma carbonio-carbonio
|
|
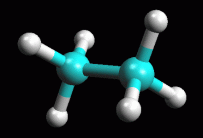
fig. 1
|
|

Etano in conformazione sfalsata
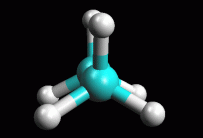
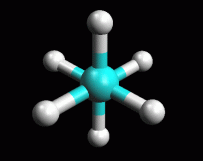 La
molecola di etano è libera di ruotare attorno al legame carbonio-carbonio,
quindi possiamo immaginare che i due metili ruotino uno rispetto all'altro
come le eliche di una nave. Durante la rotazione, però, la posizione
reciproca degli idrogeni dei metili cambia leggermente. Si possono individuare
due conformazioni per l'etano chiamate conformazione sfalsata
(fig. 1) ed eclissata (fig. 2). La
molecola di etano è libera di ruotare attorno al legame carbonio-carbonio,
quindi possiamo immaginare che i due metili ruotino uno rispetto all'altro
come le eliche di una nave. Durante la rotazione, però, la posizione
reciproca degli idrogeni dei metili cambia leggermente. Si possono individuare
due conformazioni per l'etano chiamate conformazione sfalsata
(fig. 1) ed eclissata (fig. 2).
Con ArgusLab potete disegnare la molecola dell'etano e osservarla mentre
un metile ruota rispetto all'altro. Potete anche calcolare l'energia
delle due conformazioni per capire qual è più stabile
e di quanto.
Usate ArgusLab per creare il modello molecolare dell'etano. Nella finestra
Calculation, Optimize Geometry, ottimizzate la molecola col metodo UFF
(figura 1).
Ruotate la molecola lungo il legame carbonio-carbonio per vedere come
cambia la sua struttura durante la rotazione (cliccate sul legame e
poi, tenendo premuti i tasti Alt e Shift, trascinate sù o giù
il mouse col pulsante sinistro premuto). Potete valutare meglio la conformazione
osservandola anche lungo il legame C-C in accordo con le proiezioni
di Newman come si vede nella figura qui sopra a destra.
Ruotate i metili fino a portate la molecola in posizione sfalsata come
in figura 1.
Ottimizzate la geometria prima col metodo UFF, poi col metodo AM1.
Calcolate l'energia della molecola con la procedura: Calculation, Energy,
AM1, start. Cliccate quindi sulla quarta icona col simbolo del foglio
per leggere un resoconto dei calcoli. In fondo al documento troverete
i dati sul DH
di formazione. Dovreste ottenere DH
= -17,4236 kcal/mol che leggeremo come DH
= -17,42 kcal/mol. Annotate questo dato per ulteriori calcoli.
|
|
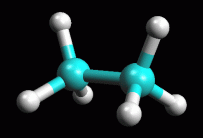
fig. 2
|
|

Etano in conformazione eclissata
 Ruotate
il legame centrale carbonio-carbonio fino ad ottenere l'etano in forma
eclissata (figura 2). Osservate la molecola anche lungo l'asse
carbonio-carbonio secondo le proiezioni di Newman come nella figura
qui a destra. Ruotate
il legame centrale carbonio-carbonio fino ad ottenere l'etano in forma
eclissata (figura 2). Osservate la molecola anche lungo l'asse
carbonio-carbonio secondo le proiezioni di Newman come nella figura
qui a destra.
Ottimizzate la molecola col metodo UFF e poi con AM1.
Calcolate l'energia della molecola col metodo AM1, leggete il foglio
dei calcoli e annotate il DH
di formazione. Dovreste ottenere DH
= -16,17 kcal/mol. La forma eclissata è quindi leggermante
meno stabile di quella sfalsata.

Barriera di potenziale
Nella reazione di interconversione dei due
isomeri conformazionali
etano eclissato => etano sfalsato .................
DH = -1,25 kcal/mol
Il DH
è quindi DH
= -17,42 + 16,17 = -1,25 kcal/mol (il valore sperimentale è -2,8
kcal/mol)
La forma sfalsata è più stabile di quella eclissata
di circa 1,25 kcal/mol.
In prima approssimazione potete considerare DG°
circa uguale a DH,
quindi siete in grado di calcolare il valore (approssimato) della K
di equilibrio per questa reazione applicando la relazione:
DG° = - RT
lnK
da cui
lnK = - DG°
/ RT
lnK = 1,25 . 4184
/ 8,31 . 298 =
2,11
K = 8,25
La K di equilibrio è quindi K = 8,25.
Questo permette di concludere che, anche con una barriera di potenziale
così piccola (1,25 kcal/mol), la forma sfalsata dell'etano
è circa 8 volte più abbondante di quella eclissata.
In altre parole una molecola di etano in rotazione conformazionale resta
per un tempo 8 volte maggiore nella forma sfalsata rispetto a quella
eclissata.
|
|
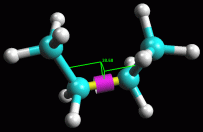
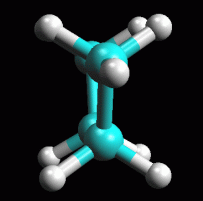
fig. 3
|
|

Conformazioni del butano
 Esaminate
ora la molecola del butano per studiare gli isomeri conformazionali
che si formano quando una parte della molecola ruota rispetto all'altra
attorno al legame C2-C3. Esaminate
ora la molecola del butano per studiare gli isomeri conformazionali
che si formano quando una parte della molecola ruota rispetto all'altra
attorno al legame C2-C3.
Create la molecola di butano con ArgusLab. Ottimizzatela col metodo
UFF. Ruotate la molecola rispetto al legame centrale carbonio-carbonio
come si vede qui a sinistra in figura 3.
Valutate in modo intuitivo la stabilità delle diverse conformazioni
che si ottengono durante la rotazione. Osservate la molecola non solo
di fianco, ma anche lungo il legame C2-C3 secondo le proiezioni di Newman
come nella figura qui a destra.
Si intuisce subito che nel butano la barriera di rotazione conformazionale
sarà maggiore rispetto all'etano perchè l'ingombro sterico
dei due metili è più grande di quello dei semplici atomi
di idrogeno.
|
|
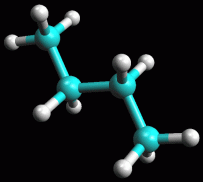
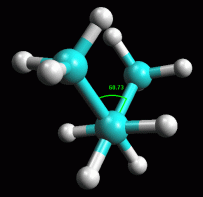
fig. 4 (anti)
|
|

Butano in conformazione sfalsata anti
 Ruotate
la molecola fino ad ottenere la conformazione sfalsata 180° anti,
cioè con i due metili da parti opposte come in figura 4.
L'angolo tra i metili dovrebbe essere esattamente di 180° come si
può apprezzare anche dalla proiezione di Newman qui a destra. Ruotate
la molecola fino ad ottenere la conformazione sfalsata 180° anti,
cioè con i due metili da parti opposte come in figura 4.
L'angolo tra i metili dovrebbe essere esattamente di 180° come si
può apprezzare anche dalla proiezione di Newman qui a destra.
Ottimizzate la molecola col metodo UFF e poi con il metodo AM1. Calcolate
l'energia della molecola con AM1. Annotate il DH
di formazione. Dovreste ottenere DH
= -31,14 kcal/mol.
|
|
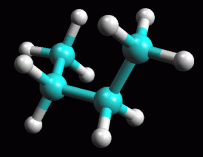
fig. 5 (gauche)
|
|

Butano in conformazione sfalsata gauche
 Ruotate
ancora la molecola attorno al suo legame centrale fino ad ottenere la
conformazione sfalsata 60° gauche, cioè con i due metili
che formano un angolo di 60° come in figura 5. Ruotate
ancora la molecola attorno al suo legame centrale fino ad ottenere la
conformazione sfalsata 60° gauche, cioè con i due metili
che formano un angolo di 60° come in figura 5.
Ottimizzate la molecola col metodo UFF e poi con AM1 più volte.
Osservate la molecola secondo la proiezione di Newman come nella figura
qui a destra: la molecola non si è assestata in modo perfettamente
simmetrico formando un angolo di 60° esatti, ma l'angolo è
di circa 74° per tenere i metili un po' più lontani uno dall'altro!
Calcolate l'energia della molecola col metodo AM1. Annotate il DH
di formazione. Dovreste ottenere DH
= -30,42 kcal/mol.
L'energia della forma gauche è quindi leggermente maggiore rispetto
alla forma anti.
|
|
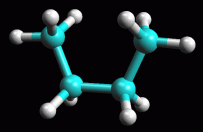
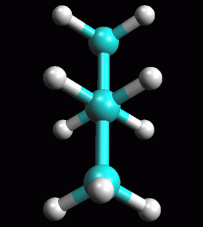
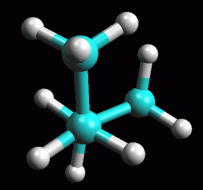
fig. 6 (eclissata 0°)
|
|

Butano in conformazione eclissata a 0°
 Ruotate
ora la molecola attorno al legame C-C centrale fino ad ottenere un angolo
esattamente di 0°. Ruotate
ora la molecola attorno al legame C-C centrale fino ad ottenere un angolo
esattamente di 0°.
E' molto importante essere precisi perchè qui la molecola non si
trova in un punto di minimo, ma in un punto di massimo dell'energia.
ArgusLab arresta i calcoli di ottimizzazione della molecola solo se nell'intorno
del punto considerato l'energia ha un andamento stazionario. Basta insomma
un piccolo errore e la molecola cade verso una conformazione più
stabile gauche.
Ottimizzate la molecola col metodo UFF. Se necessario ripetete l'operazione
di portare manualmente a zero l'angolo tra i metili e ottimizzare la molecola
con UFF fino a quando la conformazione resta in perfetto equilibrio nella
posizione eclissata a 0° come in figura 6.
Ottimizzate ora col metodo AM1. Calcolate l'energia della molecola con
AM1. Annotate il DH
di formazione. Dovreste ottenere DH
= - 27,86 kcal/mol. Questo è il valore maggiore tra le varie conformazioni
del butano, la conformazione eclissata a 0° è infatti
quella meno stabile.
|
|
|
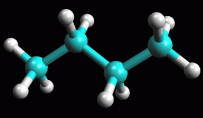
fig. 7
|
|

Barriera di potenziale
Calcolate innanzitutto la differenza di entalpia
tra la conformazione del butano sfalsata anti e quella eclissata a 0°
relativa alla trasformazione:
Butano eclissato 0° => Butano sfalsato 180° anti ...............................
DH = - 3,28 kcal/mol
DH = - 31,14
+ 27,86 = - 3,28 kcal/mol (il valore sperimentale è 4,5 kcal/mol)
La K di equilibrio per la reazione è quindi circa:
lnK = 3,28 . 4184 / 8,13 . 298 = 5,54
K = 255
La K di equilibrio è quindi K = 255. Quindi una molecola di butano
che resta per un attimo nella conformazione eclissata a 0° resta
poi un tempo 255 volte più lungo nella conformazione sfalsata
180° anti più stabile.
Nello stesso modo si può valutare la differenza di energia tra
la conformazione anti e quella gauche.
Butano sfalsato 60° gauche => Butano sfalsato 180° anti
.................. DH
= - 0,72 kcal/mol
DH = - 31,14
+ 30,42 = - 0,72 kcal/mol (in ottimo accordo con il valore sperimentale
di 0,8 kcal/mol)
Qui la differenza di energia è moto minore quindi anche la forma
gauche è relativamente stabile.
Nei cicloalcani, per esempio, la forma gauche è la conformazione
più stabile che la molecola può assumere.
Quando invece consideriamo alcani lineari, la conformazione che assumono
in fase solida è quella anti, mentre in fase liquida
la molecola ha più libertà di movimento.
In ogni caso quando si disegna un alcano è preferibile utilizzare
la conformazione anti che porta a disegnare le catene disponendo
i carboni a zig-zag come in figura 7.
Autore: prof Mauro
Tonellato
|
|
|

|
|

 Chimica al Computer
Chimica al Computer
 PianetaChimica home
PianetaChimica home
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 Ruotate
ancora la molecola attorno al suo legame centrale fino ad ottenere la
conformazione sfalsata 60° gauche, cioè con i due metili
che formano un angolo di 60° come in figura 5.
Ruotate
ancora la molecola attorno al suo legame centrale fino ad ottenere la
conformazione sfalsata 60° gauche, cioè con i due metili
che formano un angolo di 60° come in figura 5. Ruotate
ora la molecola attorno al legame C-C centrale fino ad ottenere un angolo
esattamente di 0°.
Ruotate
ora la molecola attorno al legame C-C centrale fino ad ottenere un angolo
esattamente di 0°.









